Общая характеристика d-элементов
Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d- или f-электронами. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
d-Элементы принято называть главными переходными элементами. Их атомы характеризуются внутренней застройкой d-подоболочек. Дело в том, что s-орбиталь их внешней оболочки обычно заполнена уже до того, как начинается заполнение d-орбиталей в предшествующей электронной оболочке.
Это означает, что каждый новый электрон, добавляемый в электронную оболочку очередного d-элемента, в соответствии с принципом заполнения, попадает не на внешнюю оболочку, а на предшествующую ей внутреннюю подоболочку.
Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Орбиталь 4s заполняется раньше, чем орбиталь 3d, потому что имеет меньшую энергию (правило Клечковского).
Следует, однако, отметить существование двух аномалий. Хром и медь имеют на своих 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или полностью заполненные подоболочки обладают большей устойчивостью, чем частично заполненные подоболочки.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов. Аналогичная аномалия наблюдается у серебра.
Все d-элементы являются металлами.
Электронные конфигурации элементов четвертого периода от скандия до цинка:
Хром
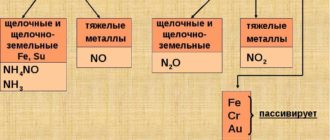
Хром находится в 4-м периоде, в VI группе, в побочной подгруппе. Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr2O3 — амфотерный оксид, CrO3 — типичный кислотный оксид со свойствами сильного окислителя, т. е. рост степени окисления сопровождается усилением кислотных свойств.
Железо
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями. FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойств.
Медь
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика. Оксиды меди: Cu2O CuO. Последний и гидроксид меди Cu(OH)2 проявляют амфотерные свойства с преобладанием основных.
Цинк
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Оксид и гидроксид цинка являются амфотерными.
Источник: http://himege.ru/d_elements/
№26 Железо
Железо известно СЃ РґСЂРµРІРЅРµР№С€РёС РІСЂРµРјС‘РЅ. Самые древние изделия РёР· железа, найденные РїСЂРё арСРµРѕР»РѕРіРёС‡РµСЃРєРёС СЂР°СЃРєРѕРїРєР°С, датируются 4-Рј тысячелетием РґРѕ РЅ. СЌ.
и относятся к древнешумерской и древнеегипетской цивилизациям.
Латинское ferrum, скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского.
РќР°Сождение РІ РїСЂРёСЂРѕРґРµ Рё получение:
Железо — РѕРґРёРЅ РёР· СЃР°РјС‹С СЂР°СЃРїСЂРѕСЃС‚СЂР°РЅС‘РЅРЅС‹С СЌР»РµРјРµРЅС‚РѕРІ РЅР° Земле Рё вообще РІ Солнечной системе. Металлическое железо РІ образует СЏРґСЂРѕ Земли, РіРґРµ его содержание, РїРѕ оценкам, около 90%.
Содержание железа в земной коре составляет 5 %, тем не менее и здесь из металлов железо уступает по распространённости только алюминию.
�з минералов наибольшее практическое значение имеют красный железняк (гематит, Fe2O3), магнитный железняк (магнетит, Fe3O4), бурый железняк или лимонит (FeOOH и FeOOH·nH2O).
Пирит FeS2 (серный или железный колчедан) используется в производстве серной кислоты.
Наиболее распространённым промышленным способом получения железа является доменный процесс, в основе которого восстановление оксидом углерода(II):Fe2O3 + 3CO = 2Fe + 3CO2
РџСЂРё этом получается железо, содержащее РґРѕ 7% углерода Рё РґСЂСѓРіРёРµ примеси — чугун. Чугун РІ дальнейшем перерабатывают РІ более чистое железо — сталь, удаляя примеси окислением РІ РјР°СЂС‚РµРЅРѕРІСЃРєРёС РїРµС‡Р°С РёР»Рё конвертераС. Сталь может быть легирована добавками РґСЂСѓРіРёС РјРµС‚Р°Р»Р»РѕРІ, для повышения ее прочности, РєРѕСЂРѕР·РёРѕРЅРЅРѕР№ стойкости Рё С‚.Рї.
�спользуется также прямой способ получения железа, в котором железные окатыши при 1000oС восстанавливают водородом, получаемым при конверсии метана: Fe2O3 + 3H2 = 2Fe + 3H2O
Физические свойства:
Железо — типичный металл, РІ СЃРІРѕР±РѕРґРЅРѕРј состоянии — серебристо-белого цвета СЃ сероватым оттенком.
Чистый металл пластичен, РєРѕРІРѕРє, различные примеси (РІ частности — углерод) повышают его твёрдость Рё Срупкость.
Обладает ярко выраженными магнитными свойствами. Tпл=1812K, Tкип=3134K.
Химические свойства:
Железо относится Рє металлам средней активности, РІ СЂСЏРґСѓ напряжений стоит РґРѕ РІРѕРґРѕСЂРѕРґР° Рё растворяется РІРѕ РјРЅРѕРіРёС РєРёСЃР»РѕС‚Р°С, РЅРѕ концентрированной серной Рё азотной кислотами пассивируется Рё РЅР° Солоду СЃ РЅРёРјРё РЅРµ реагирует. Раскаленное железо реагирует СЃ водяным паром: 3Fe + 4H2O = Fe3O4 + 4H2 (раньше так получали РІРѕРґРѕСЂРѕРґ для наполнения аэростатов).РџСЂРё нагревании железо реагирует СЃРѕ РјРЅРѕРіРёРјРё неметаллами, часто образуя соединения нестеСиометрического состава карбиды, Р±РѕСЂРёРґС‹, силициды, нитриды Рё РґСЂ.
Наиболее Сарактерными для железа являются степени окисления +2 Рё +3, известны также соединения, РіРґРµ железо имеет степень окисления +6.
Важнейшие соединения:
Степень окисления +2 — основный РѕРєСЃРёРґ FeO (чёрный), РіРёРґСЂРѕРєСЃРёРґ Fe(OH)2 (зеленый). Соли железа(II) (бледно-зеленого цвета), образуют кристаллогидраты (напр. железный РєСѓРїРѕСЂРѕСЃ, FeSO4*7H2O), легко окисляются кислородом РґРѕ соединений железа(III).
Степень окисления +3 — наиболее устойчивая степень окисления железа, ей соответствуют: РѕРєСЃРёРґ Fe2O3 Рё РіРёРґСЂРѕРєСЃРёРґ Fe(OH)3 (РѕР±Р° — коричневого цвета), соли железа(III) — (образуют кристаллогидраты, РІ СЂР°СЃС‚РІРѕСЂР°С СЃРёР»СЊРЅРѕ гидролизованы). Рў.Рє. РѕРєСЃРёРґ железа(III) проявляет слабые основные свойства, РѕРЅ частично растворим РІ РєРѕРЅС†. щелочаС, Р° РїСЂРё сплавлении СЃРѕ щелочами образует соотв. соли — ферриты: Fe2O3 + 2NaOH = 2NaFeO2 + H2O РџСЂРё растворении ферриты нацело гидролизуются.
Смешаный РѕРєСЃРёРґ, Fe3O4 или FeO*Fe2O3, («Р¶РµР»РµР·РЅР°СЏ окалина») можно рассматривать также как феррит железа(II): Fe(FeO2)2. РџСЂРё взаимодействии его СЃ растворами кислот образуется смесь солей железа (II) Рё (III).
Для железа РІ степени окисления +2 Рё +3 Сарактерно образование РјРЅРѕРіРѕС‡РёСЃР»РµРЅРЅС‹С РєРѕРјРїР»РµРєСЃРЅС‹С СЃРѕРµРґРёРЅРµРЅРёР№, например С‚Р°РєРёС РєР°Рє гексацианоферрат(II) калия K4[Fe(CN)6] («Р¶РµР»С‚ая кровяная соль») Рё гексацианоферрат(III) калия K3[Fe(CN)6] («РєСЂР°СЃРЅР°СЏ кровяная соль»).
РџСЂРё взаимодействии РёРѕРЅРѕРІ Fe3+ Рё [Fe(CN)6]4- выпадает СЏСЂРєРѕ-СЃРёРЅРёР№ осадок гексацианоферрата(II) калия-железа(III) (берлинская лазурь): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl. Рто качественная реакция для обнаружения РёРѕРЅРѕРІ Fe3+.
Аналогичная реакция используется для открытия РёРѕРЅРѕРІ железа(II): FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl; («С‚урнбулева СЃРёРЅСЊ»).
Степень окисления +6 — Ферраты — соли РЅРµ существующей РІ СЃРІРѕР±РѕРґРЅРѕРј РІРёРґРµ железной кислоты H2FeO4.
Рто соединения фиолетового цвета, РїРѕ окислительным свойствам напоминающие перманганаты, Р° РїРѕ растворимости — сульфаты. Ферраты — сильные окислители.
Получают ферраты РїСЂРё действии газообразного Слора или РѕР·РѕРЅР° РЅР° взвесь Fe(OH)3 РІ щелочи: 2Fe(OH)3 + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O
Применение
— Железо является основным компонентом сталей Рё чугунов — РІР°Р¶РЅРµР№С€РёС РєРѕРЅСЃС‚СЂСѓРєС†РёРѕРЅРЅС‹С РјР°С‚РµСЂРёР°Р»РѕРІ.
— Железо может РІСодить РІ состав сплавов РЅР° РѕСЃРЅРѕРІРµ РґСЂСѓРіРёС РјРµС‚Р°Р»Р»РѕРІ — например, никелевыС.
— Железо применяется РІ качестве анода РІ железо-РЅРёРєРµР»РµРІС‹С Р°РєРєСѓРјСѓР»СЏС‚РѕСЂР°С, железо-РІРѕР·РґСѓС€РЅС‹С Р°РєРєСѓРјСѓР»СЏС‚РѕСЂР°С.
Биологическая роль и физиологическое действие
Железо РІСРѕРґРёС‚ РІ состав гемоглобина РєСЂРѕРІРё, обеспечивая, Р·Р° счет СЃРІРѕРёС РѕРєРёСЃР»РёС‚РµР»СЊРЅРѕ-РІРѕСЃСЃС‚Р°РЅРѕРІРёС‚РµР»СЊРЅС‹С СЃРІРѕР№СЃС‚РІ, ее важнейшую функцию, транспорт кислорода РІ ткани организма.
В крови взрослого человека содержится около 4 г железа, его недостаток приводит к заболеванию железодефицитной анемией.
Восполнить недостаток железа можно Р·Р° счет РїРёС‰РµРІС‹С РїСЂРѕРґСѓРєС‚РѕРІ, СЃРѕРґРµСЂР¶Р°С‰РёС Р¶РµР»РµР·Рѕ РІ Сорошо усвояемой форме (печень, РјСЏСЃРѕ, бобовые) или медикаментов.
�збыточное накопление железа в организме оказывает токсическое действие. ПДК железа в воде 0,3 мг/л.
Аксенова �рина, Пуртова Ксения, ТюмГУ, 502(1) группа, 2013 г.
�сточники:
Железо// Википедия. URL: http://ru.wikipedia.org/wiki/Железо (дата обращения: 6.01.2014).
Источник: http://www.kontren.narod.ru/x_el/info26.htm
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия.
В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5.
Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности.
Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6 2) +3, +6, +6 3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода 2) порядковому номеру химического элемента 3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода 2) порядковому номеру химического элемента 3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3 2) –3, +5 3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2 2) II, –1 3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5 2) II, –1 3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3 2) III, +3 3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом 2) натрием 3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций 2) железо 3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор 2) фосфор и хлор 3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород 2) углерод и фосфор 3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор 2) железо 3) кислород
4) фтор
Ответы
Источник: https://himi4ka.ru/ogje-2018-po-himii/urok-4-valentnost-himicheskih-jelementov-stepen-okislenija-himicheskih-jelementov.html
Как определить степень окисления. Определение степени окисления соединений
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
«>
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
«>
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности.
У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента.
Сумма всех степеней окисления должна быть равна нулю.
«>
Пример определения в серной кислоте
Формула данного соединения имеет вид H2SO4. У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
«>
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Мы уже знаем о существовании заряженных частиц-ионов. Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента.
Записи Na+, Ca2+, Al3+ означают, что атомы данных элементов потеряли соответственно 1, 2, 3 е-, а записи F-, O2-, N3- означают, что атомы данных элементов приобрели соответственно 1, 2, и 3е- . Степени окисления элементов. Для определения состава молекулярных соединений (SO2, NH3, CO2 и т. д. ) и ионных простых соединений (Na2O, Na2SO4 и т. д.) .
При оценке степени окисления элементов соединения представляют расщеплёнными на одноатомные ионы. Степень окисления-это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, причём знак ставится перед числом: -1, -2, +3, в отличии от заряда иона, где знак ставится после числа.
r/>В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0. Степени окисления металлов в соединениях всегда положительные, высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключая некоторые элементы: золото Au+3 (I группа) , Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru. Степени неметаллов могут быть как положительными так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и +, и — ( об этом вы узнаете при изучении ряда электроотрицательностей) . Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое ( число электронов соответствует номеру группы) . Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
При определении степеней окисления необходимо использовать следующие правила:
Источник: https://znaivse.biz/obrazovanie/kak-opredelit-stepen-okisleniya-20-01-2020.html
Витамин C – нужно ли принимать добавки или это коммерческий ход?
Моя специальность и работа никак не связана с витаминами и с химией в целом, но так вышло, что тема витаминов и питания меня заинтересовала. Я решил разобраться в ней насколько это возможно и узнать стоит ли принимать витамин С.
Забота о своем здоровье наиболее актуальная тема, особенно сегодня. Я тоже не прошел ее стороной и опишу ниже как я познакомился с добавками в виде витамина C.
Однажды мной была найдена интересная статья с рекомендацией по употреблению в дополнение к рациону питания витамина С. Под руку попался instagram-аккаунт одного нутрициолога.
Нутрициолог рекомендует добавить в свой рацион органический витамин С.
Почему именно органический? Утверждается, что органический витамин С лучше усваивается и излишки легко выводятся из организма. Естественно это дороже, 1000мг стоит 13$. Почему добавить? Потому что его необходимо очень много, но мы его не получаем из еды.
Практически всегда информация о витамине С сопровождается описанием его полезности [1]. Доходит до того, что витамин С пытались использовать для борьбы с онкологическими заболеваниями. Дальше я попытаюсь вкратце изложить изученный мной материал.
Витамин С
Витамин C (L-аскорбиновая кислота) является мощным антиоксидантом, который помогает укрепить иммунитет, облегчает всасывание в кишечнике и усвоение организмом железа и необходим для нормального функционирования соединительной и костной ткани. Наш организм не может запасать витамин С, поэтому необходимо постоянно получать его дополнительно.
Получение органического витамина С из шиповника
На просторах интернета я нашел курсовую статью о получении органического витамина С из шиповника [2]. Плоды шиповника подают в диффузор (температура 70—75° С). Диффузионный сок направляют через фильтр-пресс в трехкорпусной выпарной аппарат, где сок сгущают до плотности 60% и перекачивают далее в распылительную сушилку для получения порошкообразного концентрата с витамином С, идущего на таблетирование.
Получение синтетического витамина C
В промышленных масштабах витамин С синтезируют. Витамин C в промышленности производится из D-глюкозы по методу Рейхштейна — Грюсснера. D-Глюкозу (19) каталитически гидрируют водородом под давлением, получая D-сорбит (30). D-сорбит ферментативно (Acetobacter suboxydans) окисляют его в L-сорбозу (23).
Циклическую форму α -L-сорбофуранозы действием ацетона и серной кислоты превращают в диизопропилиденсорбозу (62). Ацетонирование сорбозы при низких температурах (–5 °С) дает существенное повышение выхода ди-О-изопропилиденового производного.
Дальнейшее окисление диацетонсорбозы до кислоты (63) обычно выполняется с помощью гипохлорита натрия в присутствии сульфата никеля. Изопропилиденовые защитные группировки снимают действием хлороводородной кислоты в безводной среде (этанол-хлороформ, 65 °С, 50 ч).
Образующаяся циклическая форма переходит в 2-оксогулоновую кислоту (64), при действии на которую кислоты происходит лактонизация; промежуточно образующееся соединение затем енолизуется, давая аскорбиновую кислоту (65).
L-Аскорбиновая кислота представляет собой кристаллическое вещество белого цвета, проявляющее достаточно сильные кислотные и восстановительные (окислительный потенциал равен +127 мВ) свойства.
Суточная доза витамина C
В большинстве источников рекомендованная суточная норма употребления витамина C составляет 90 мг для мужчин и 75 мг для женщин. Подросткам требуется от 65 до 75 мг витамина C в день, а детям — порядка 35-50 мг. Повышенную потребность в витамине C испытывают курильщики, потому что одна сигарета разрушает 25 мг витамина C.
В instagram и на своем сайте упомянутый ранее нутрициолог утверждает, что нам необходимо намного больше, примерно 5 грамм органического витамина С, но все индивидуально.
На сайте ВОЗ немного исследований, связанных с витамином С. Исследования на сайте ВОЗ: «Прием добавок витамина C во время беременности» [3].
Сильная нехватка витамина C приводит к развитию цинги. Симптомы цинги появляются, когда уровень витамина C в плазме крови падает ниже 11 мкг/л или общие запасы в организме – ниже 300 мг.
Избыток витамина C при приеме витаминных добавок обычно хорошо переносится здоровыми людьми, хотя возможно развитие воспаления кишечного тракта и диареи. Другой потенциальный, но редкий побочный эффект включает повышенную экскрецию оксалатов с мочой с увеличенным риском образования почечных камней.
Органический и синтетический витамин C
В этой теме все более неоднозначно. Рекомендуемый к покупке органический витамин С — 100% вытяжка из кукурузы (указано в описании товара на сайте магазина). Также рекомендуется отказаться от синтетического витамина С, т.к.
он может не только быть бесполезен, но и вреден [4].
Однако исследование различий между синтетическим и органическим витамином C проведенное «Центром исследований свободных радикалов» показало, что влияние на организм человека органический и синтетический витамин С оказывают одинаково [5].
Витамин C как средство от рака
Интерес к витамину C как средству от рака возник около 30 лет назад с подачи нобелевского лауреата Лайнуса Полинга.
Имя Полинга известно также широкой общественности благодаря его пропаганде, основанной на личном примере, употребления больших доз аскорбиновой кислоты (витамина С) в качестве пищевой добавки для улучшения общего здоровья и предотвращения (или хотя бы уменьшения тяжести протекания) таких заболеваний, как простуда и рак. Так появился термин «Ортомолекулярная медицина».
Ортомолекулярная медицина — одна из разновидностей альтернативной медицины. Методы ортомолекулярной медицины предполагают терапию и профилактику заболеваний различными витаминами, аминокислотами, питательными веществами в форме биологически активных добавок (БАД) и продуктов питания. Витамин С также необходим для формирования волокон коллагена, для защиты тканей организма от свободных радикалов.
Полинг предложил повысить ежедневную дозу витамина С в 100—200 раз. Для формирования коллагеновых волокон, то есть для выполнения функции коэнзима, достаточно было 10 мг аскорбиновой кислоты. Однако Полинг утверждал, что аскорбиновая кислота как антиоксидант может выполнять множество других функций и обеспечивать защиту клеток и тканей от повреждений свободными радикалами кислорода.
Для первого клинического испытания лечебных свойств мегадоз витамина C Институт Лайнуса Полинга выбрал сверхсложную задачу — доказать возможность излечения тех больных раком людей, которые были признаны безнадежными и которым уже не помогало ни радиационное лечение, ни химиотерапия, а развившиеся метастазы исключали хирургическое вмешательство. Группа Полинга предполагала лечить их аскорбиновой кислотой, дозами по 10 г в день, положительный результат состоял в том, что, получая мегадозы витамина C, они якобы жили значительно дольше, чем те «безнадежные», которые не получали этого витамина. Поэтому и был сделан вывод, что с его помощью возможно «продление жизни».
Лайнус Полинг умер 19 августа 1994 года в возрасте 93 лет. Пропаганда целебных свойств высоких доз витамина С после смерти Полинга значительно ослабла. В научной литературе стали появляться результаты исследований негативных последствий от приема высоких доз аскорбиновой кислоты.
Европейский суд принял решение об ограничениях дозировок препаратов витамина С в странах ЕС с 1 августа 2005 г. Изменены формулировки рекомендаций (слова «лечит», «излечивает», «продлевает» и т. п. заменены на «способствует сохранению», «защищает»).
Меня насторожило, что витамин С – мощный антиоксидант, но, судя по последним исследованиям, хотя именно витамин С не упоминается, антиоксиданты могут ускорять рак [6]. Поэтому с каждым новым исследованием меняется отношение к употреблению витамина С при онкологических заболеваниях.
Вывод
Витамин C однозначно необходим нашему организму. Лучшими источниками витамина C являются овощи и фрукты, ягоды. Также, в отличии от добавок витамина C, употребление овощей, фруктов и ягод помогает получить и другие витамины.
Продукты с высоким содержанием витамина С:
- Шиповник (сухой – 1200 мг/100г, свежий – 650 мг/100г)
- Перец сладкий (болгарский) (200 мг/100г)
- Чёрная смородина (200 мг/100г)
- Облепиха (200 мг/100г)
- Петрушка (зелень) (150 мг/100г)
При отсутствии в рационе питания овощей и фруктов необходимо найти дополнительный источник витаминов. Для проверки концентрация аскорбиновой кислоты витамина C можно сдать анализ витамина C в плазме крови.
Слишком мало информации о получении органического витамина С в промышленных масштабах и о его различии с синтетическим, например, аскорбинки из аптеки. Возможно, это коммерческий ход, который активно продвигают в своих instagram-аккаунтах нутрициологи, зарабатывая на рекламе.
Положительное влияние витамина С при уже обнаруженной онкологии очень спорно, т.к. с каждым годом показывают разные результаты. Перед употреблением лучше проконсультироваться с врачом.
Большие дозы могут отрицательно влиять на организм [7], поэтому, в случае, если вы решили все таки употреблять витамины в качестве добавки, необходимо проконсультироваться с врачом и с помощью анализов убедиться в необходимости добавки.
Некоторые вопросы для меня остались актуальны и без ответа:
- Существует ли органический витамин С в таблетках и есть ли отличие от синтетического?
- Можно ли доверять мнению нутрициолога или обязательна консультация врача диетолога?
Ссылки
Источник: https://habr.com/ru/post/484692/
Валентность железа. Какая валентность у железа?
Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.
Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.
Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.
Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).
Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.
Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода.
То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода.
Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.
Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.
Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Источник: https://FB.ru/article/339377/valentnost-jeleza-kakaya-valentnost-u-jeleza