Железо
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.).
Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
Происхождение названия
Имеется несколько версий происхождения славянского слова «железо» (белор. жалеза, укр. залізо, ст.-слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo).Одна из этимологий связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень».
Третья версия предполагает древнее заимствование из неизвестного языка.Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum . Латинское ferrum (< *ferzom), скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla.Германские языки заимствовали название железа (готск. eisarn,англ. iron, нем.
Eisen, нидерл. ijzer,дат. jern, швед. järn) из кельтских.Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой».
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра.
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно.
В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C.
В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода. В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III).
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида. Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород.
Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Источник: http://edu.glavsprav.ru/info/fe/
Получение железа из руд. Прямое получение железа. Восстановление железа из руд. Получение губчатого железа. | мтомд.инфо
Под процессами прямого получения железа понимают такие химические, электрохимические или химико-термические процессы, которые дают возможность получать непосредственно из руды, минуя доменную печь, металлическое железо в виде губки, крицы или жидкого металла. Такие процессы ведутся, не расходуя металлургический кокс, флюсы, электроэнергию (на подготовку сжатого воздуха), а также позволяют получить очень чистый металл.
Методы прямого получения железа известны давно. Опробовано более 70 различных способов, но лишь немногие осуществлены и притом в небольшом промышленном масштабе.
В последние годы интерес к этой проблеме вырос, что связано, помимо замены кокса другим топливом, с развитием способов глубокого обогащения руд, обеспечивающих не только высокого содержания железа в концентратах (7072%), но и почти полное освобождение его от серы и фосфора.
Получение губчатого железа в шахтных печах
При получении губчатого железа добытую руду обогащают и получают окатыши. Окатыши из бункера 1 по грохоту 2 поступают в короб 10 шихтозавалочной машины и оттуда в шахтную печь 9, работающую по принципу противотока.
Просыпь от окатышей попадает в бункер 3 с брикетировочным прессом и в виде окатышей вновь поступает на грохот 2.
Для восстановления железа из окатышей в печь по трубопроводу 8 подают смесь природного и доменного газов, подвергнутую в установке 7 конверсии, в результате которой смесь разлагается на водород H2 и оксид углерода CO.
Установка для прямого восстановления железа из руд и получения металлизованных окатышей
В восстановительной зоне печи В создается температура 10001100 0C, при которой H2 и CO восстанавливают железную руду в окатышах до твёрдого губчатого железа. железа в окатышах достигает 9095%. Для охлаждения железных окатышей по трубопроводу 6 в зону охлаждения 0 печи подают воздух. Охлаждённые окатыши 5 выдаются на конвейер 4 и поступают на выплавку стали в электропечах.
Восстановление железа в кипящем слое
Мелкозернистую руду или концентрат помещают на решётку, через которую подают водород или другой восстановительный газ под давлением 1,5 МПа. Под давлением водорода частицы руды находятся во взвешенном состоянии, совершая непрерывное движение и образуя «кипящий», «псевдосжиженый» слой. В кипящем слое обеспечивается хороший контакт газа-восстановителя с частицами оксидов железа. На одну тонну восстановленного порошка расход водорода составляет 600650 м3.
Получение губчатого железа в капсулах-тиглях
Используют карбидокремниевые капсулы диаметром 500 мм и высотой 1500 мм. Шихта загружается концентрическими слоями. Внутренняя часть капсулы заполнена восстановителем – измельченным твердым топливом и известняком (1015%) для удаления серы.
Второй слой – восстанавливаемая измельченная руда или концентрат, окалина, затем еще один концентрический слой – восстановителя и известняка.
Установленные на вагонетки капсулы медленно перемещаются в туннельной печи длиной до 140 м, где происходит нагрев, выдержка при 1200 0C и охлаждение в течение 100 часов.
Восстановленное железо получают в виде толстостенных труб, их чистят, дробят и измельчают, получая железный порошок с содержанием железа до 99 %, углерода – 0,10,2%.
Источник: http://www.mtomd.info/archives/1834
Что делают из железной руды?
Оглянитесь вокруг. Так или иначе, но вы со стопроцентной вероятностью наткнетесь на что-то, чьим компонентом является элемент Ferrum. Он же – железо. Даже телефон, планшет или компьютер, с помощью которого вы читаете данную статью, также содержит в себе железо.
Феррум является четвертым по многочисленности элементом на нашей планете. Являясь настолько популярным, оно максимально упрощает процесс собственной добычи. К сожалению, в чистом виде оно все-таки не встречается, потому – придется добывать его из руды. Благо, извлечь его из минералов и получить чистый «Fe» намного проще, чем, скажем, уран или даже алюминий.
В данной статье мы рассмотрим вопрос, что делают из железной руды, как из нее добывается железо и куда его применяют.
Свойства руд
Отвечать на вопрос: какими свойствами обладает железная руда, не совсем просто. Хотя бы потому, что перечень свойств зависит от процента данного металла в руде и количества посторонних примесей. К примеру, красный железняк, содержащий гематит (Fe2O3), содержит в себе целых 70% железа от общего количества.
https://www.youtube.com/watch?v=ouHtL2Mu7dw
В общем и целом, кстати, целесообразной добычей железа считается только та, где в рудах содержится от 40% железа и выше. Данная цифра действительно дает понять, что железо распространено в окружающем мире многократно больше других элементов. К примеру, для того же урана, содержание его в руде в количестве 2% считалось бы небывалой удачей
Но вернемся к нашему красному железняку. Давая характеристику железной руде, можно сказать, что красный железняк представляет собой диапазон от порошкового вещества до плотного.
Лимонит (он же – бурый железняк), также является рудой железа, однако она представляет собой пористую и рыхлую породу, содержащую весомые доли фосфора и марганца. Пустой породой у него часто выступает глина. В силу чего, кстати, довольно легко поддается извлечению железа. Потому из него часто делают чугун.
Шпатовый железняк с сидеритом во главе является довольно редким минералом, что не делает его производственным ресурсом. Он также содержит в себе довольно много глины.
Черно-синие магнитные руды по своей насыщенности железу могут не уступать красному железняку. Но главной их особенностью является, конечно, свойства магнетизма. Пусть они и теряются с сильным повышением температуры. Пусть железняк магнитный намного реже других, но польза его очевидна.
Способы добычи железа из руды
Железо из руды наиболее часто получают в доменных печах. Принцип работы такого способа заключается в восстановлении железа из его оксидов с помощью угля, в виде кокса. Уголь, окислившись в печи под воздействием кислорода, превращается в угарный газ (СО). Затем, нагретый в печи угарный газ взаимодействует с оксидом железа (Fe2O3), вследствие чего получаются молекулы углекислого газа и молекулы восстановленного железа.
Полученное железо все еще не является идеально чистым. Дабы устранить его от всяческих рудных примесей, далее используется флюс. Флюсом называют карбонаты кальция или магния (в простонародье – известняк и доломит). При нагревании до 1000 градусов по Цельсию, карбонаты распадаются на свои оксиды с выделением углекислого газа.
СаСО3 → СаО+СО2
Далее, оксид кальция или магния вступает в реакцию с примесями железа (например – с кварцем)
CaO+SiO2 → CaSiO3
Получившийся в результате шлак очень легко плавится в печи. Он плавает на поверхности, что позволяет довольно легко отделить его от железа. Такой расплав железа является все равно не самым чистым из-за существенного присутствия атомов карбона (уголь). А сплав железа с углеродом называется чугуном.
Железо довольно активный элемент, потому весьма податлив коррозии. Потом, не стоит оставлять под открытым небом или в местах с повышенной влажностью предметы с высоким содержанием железа.
Добыча железа в России и мире
Россия в плане добычи железной руды может похвастаться лишь 5-6% от общемирового уровня. Но что касается запасов для потенциально дальнейшей добычи – здесь уверенное первое место. 18% от всей мировой железной руды находятся именно в России. На втором и третьем месте – Бразилия с Австралией. Почетное четвертое место досталось «сожителю по СССР» – Украине, 11 процентов.
В Российской Федерации наибольшим месторождением железной руды является Курская магнитная аномалия. Она же, кстати, является крупнейшим месторождением всей планеты. Запасы залегающего там необработанного железа исчисляются 30 миллиардами тонн.
Применение железа
Примечательным можно считать тот факт, что из самого Феррума, в его химически чистой форме, в мире практически ничего не делается и не производится. Данный элемент очень легко окисляется, вступая в реакции в кислородом или другими элементами.
Так для чего нужна железная руда? Все просто. Феррум, обогащенный карбоном (сплав чугуна) – весьма и весьма популярный материал.
Чугун может или служить самостоятельной единицей для изготовления каких-либо вещей и предметов, или же быть промежуточным звеном между железом, и сталью.
Сталь – это сплав железа, углерода и других элементов. Железа должно быть не менее 45%, карбона – от 0,02 до 2,14 процента. Если выше 2,14% – это уже чугун. И уж сталь-то, в десятках своих вариаций, в наше время используется практически везде.
Машиностроение, авиация, приборостроение, космические постройки, ядерная энергетика, медицина (существует даже термин – хирургическая сталь), оружейная отрасль (как холодное, так и огнестрельное), сельхозинвентарь, строительная продукция и т.д.
За счет такой популярности стали, смело можно утверждать, что ни один металл периодической таблицы не используется так интенсивно и в таких количествах на Земле, как железо.
Действительно, сфер производства продукции железной руды, а также соединений и сплавов на основе Феррума – просто не счесть. Однако, в будущем, при таких темпах и масштабах добычи, перед человечеством могут встать два вопроса: что делать, когда запасы этого металла в недрах нашей планеты станут иссякать? И как поступать с теми гигантскими котлованами по всей планете, которые остаются после проведения добычи железной руды открытым способом?..
Источник: https://geomix.ru/blog/minerals/chto-delayut-iz-zheleznoj-rudy/
Железо в организме человека: для чего оно нужно и чем опасен железодефицит
Железа, которое содержится в теле человека, хватит на крупный гвоздь. Это приблизительно 2,5–4,5 грамм. Казалось бы, совсем немного. Тем не менее влияние железа на многие жизненно важные процессы огромно, и его недостаток (как и избыток) моментально сказывается на нашем самочувствии и может привести к серьезным последствиям.
Роль железа в организме: микроэлемент с важной миссией
У железа очень много функций. Вот основные из них:
- Транспортировка кислорода к тканям. Железо входит в состав гемоглобина — белка, из которого состоят красные кровяные тельца (эритроциты). Именно железо отвечает за захват кислорода, после чего эритроциты переносят его ко всем органам и системам организма. Эти же кровяные тельца (и снова при помощи железа!) подбирают отработанный углекислый газ и транспортируют его в легкие для утилизации. Без железа дыхательные процессы на клеточном уровне были бы просто невозможны.
- Метаболизм. Железо в организме человека является составной частью многих ферментов и белков, которые необходимы для обменных процессов — разрушения и утилизации токсинов, холестеринового обмена, превращения калорий в энергию. Оно также помогает иммунной системе организма справляться с агрессорами.
Нет ничего удивительного в том, что недостаток железа отражается на внешности, здоровье и самочувствии.
При дефиците этого элемента кожа становится бледной и сухой, волосы — тусклыми и слабыми, а ногти — ломкими. В уголках губ возникают незаживающие язвочки, а на кистях рук и ступнях — очень болезненные трещины.
По мере снижения количества железа в организме самочувствие ухудшается — пропадает аппетит, многие замечают дискомфорт при глотании. Иногда вкусы меняются самым странным образом, например, человеку очень хочется погрызть мел или пожевать бумагу.
Люди с нехваткой железа испытывают постоянный упадок сил — они даже просыпаются уставшими. Малейшие физические нагрузки вызывают сильную одышку — так сказывается недостаток кислорода. Другие типичные симптомы дефицита железа — головокружения и даже обмороки, сонливость, раздражительность, ухудшение памяти.
Для людей, страдающих нехваткой железа, типичны постоянные простуды и кишечные инфекции. Как мы уже говорили, железо принимает непосредственное участие в работе защитной системы организма, и при его дефиците иммунитет не может вовремя отражать атаки болезнетворных бактерий.
Наверняка многим эти симптомы покажутся очень знакомыми. Ничего удивительного: по статистике ВОЗ, примерно у 60% населения планеты отмечается недостаток железа в организме, а у 30% дефицит этого элемента так велик, что речь идет уже о железодефицитной анемии — состоянии, при котором значительно понижается уровень гемоглобина.
Интересный факт
Железодефицитная анемия — самый распространенный тип анемии, на нее приходится более 90% всех случаев.
Норма содержания, или Сколько железа мы «носим»?
Как уже было сказано, в нашем организме содержится 2,5–4,5 г железа, и его запас необходимо постоянно пополнять.
Женщинам требуется больше железа, чем мужчинам — это объясняется ежемесячными кровопотерями во время менструаций, а также некоторыми особенностями гормональной системы. В среднем женщина должна ежедневно получать 15 мг железа, а во время беременности и лактации — 20 мг и даже больше.
Мужчинам необходимо 10 мг железа ежедневно.
Детям и подросткам до 18 лет необходимо получать 5–15 мг железа в сутки — потребность в этом элементе повышается с возрастом.
Важно!
Рацион питания современного человека практически не позволяет получать достаточное количество железа с пищей. В среднем мы потребляем около 10–20% от ежедневной нормы железа. Остальное можно восполнить при помощи биодобавок и витаминных комплексов.
Ничто не дает такого точного представления об уровне железа в организме, как обычный биохимический анализ крови, который можно сделать в любой лаборатории.
Нормальный уровень железа для мужчин — от 11,64 до 30,43 мкмоль/л, у женщин — от 8,95 до 30,43 мкмоль/л. У новорожденных детей норма содержания железа в крови гораздо выше — от 17,9 до 44,8 мкмоль/л. Но уже к концу первого года жизни она понижается до 7,16–17,9 мкмоль/л, а к пубертатному периоду достигает взрослых показателей.
Недостаток и переизбыток железа в организме человека: причины и последствия
Избыток железа встречается гораздо реже, чем недостаток. Такая ситуация часто складывается при очень высоком содержании железа в питьевой воде, при болезнях печени и селезенки, а также при метаболических нарушениях.
Избыток железа включает такие симптомы, как непрекращающиеся расстройства пищеварения (метеоризм, диареи и запоры, тошнота и рвота, изжога), упадок сил и головокружения, появление пигментации на коже. Если не предпринимать никаких мер, возможно развитие осложнений — артритов, диабета, заболеваний печени.
Некоторые специалисты также полагают, что переизбыток железа — один из факторов риска при развитии онкологических заболеваний.
Недостаток железа диагностируется гораздо чаще. И, как правило, он вызван несбалансированной диетой, бедной этим элементом.
Другие типичные причины недостатка железа в организме — его активный расход (во время роста, беременности и кормления грудью), кровопотери из-за травм, операций, внутренних кровотечений или обильных менструаций, гастриты, глистные инвазии и дисбактериозы (из-за этих болезней нарушается процесс всасывания железа), нехватка витаминов С и В12, без которых железо не усваивается, нарушения в работе щитовидной железы и отравление свинцом.
Снижение иммунитета, вызванное нехваткой железа, рано или поздно приводит к тому, что инфекционные заболевания приобретают хронический характер, и это одна из главных опасностей дефицита железа. Железодефицитная анемия — значительный фактор риска при развитии сердечной недостаточности и заболеваний печени. Особенно опасна анемия для беременных — у матерей, страдавших ею во время вынашивания ребенка, часто рождаются дети с врожденной анемией.
Как поднять уровень железа?
Даже если анализ крови показал дефицит железа в организме, не стоит немедленно бежать в аптеку за минеральным комплексом и считать, что вопрос закрыт. Необходима консультация врача, так как недостаток железа в организме может говорить о наличии серьезных заболеваний, при которых всасывание железа нарушено.
Если дефицит железа в организме вызван неправильным питанием, это легко поправить.
Диета. Необходимо есть как можно больше продуктов с высоким содержанием железа. Самые ценные его источники — красное мясо, субпродукты (особенно печень), устрицы, яйца, орехи, бобовые, яблоки, гранаты, изюм, инжир.
Нужно также пополнить рацион продуктами, которые содержат витамин С (облепиха, шиповник, брюссельская капуста, цитрусовые) и витамин В12 (рыба и морепродукты), они нужны для того, чтобы поступающее железо усваивалось.
Употребление чая, кофе и газировки лучше ограничить, а от алкоголя следует отказаться совсем.
Витаминные комплексы. Дополнительный прием витаминов — эффективный способ профилактики дефицита железа в организме. Помимо этого элемента, в комплекс должны входить витамины А, С, Е и D, все витамины группы В, а также медь, марганец и цинк — это оптимальный состав «спасательной команды» при железодефиците.
БАДы. Существует немало биологически активных добавок для людей, страдающих нехваткой железа. Самым известным БАДом для улучшения состояния при анемии является, пожалуй, знакомый всем с детства гематоген. Это сладкая плитка, напоминающая ирис и содержащая большое количество альбумина — природного источника железа.
Если у дефицита железа в организме нет других причин, кроме неправильного питания, уже через месяц-другой при помощи диеты, БАДов и витаминов можно добиться улучшения. А чтобы ускорить процесс, рекомендуем больше двигаться — физическая активность способствует насыщению тканей кислородом и помогает справиться с усталостью и сонливостью — первыми признаками нехватки железа.
Источник: https://www.kp.ru/guide/zhelezo-v-organizme-cheloveka.html
Физические и химические свойства железа
А томный номер — 26. Символ – Fe (лат. «ferrum»). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Физические свойства железа
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d64s2. В своих соединениях железо проявляет степени окисления «+2» и «+3». Температура плавления железа – 1539С.
Железо образует две кристаллические модификации: α- и γ-железо. Первая из них имеет кубическую объемноцентрированную решетку, вторая – кубическую гранецентрированную. α-Железо термодинамически устойчиво в двух интервалах температур: ниже 912 и от 1394С до температуры плавления.
Между 912 и 1394С устойчиво γ-железо.
Механические свойства железа зависят от его чистоты – содержания в нем даже весьма малых количеств других элементов. Твердое железо обладает способностью растворять в себе многие элементы.
Химические свойства железа
Во влажном воздухе железо быстро ржавеет, т.е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления. В воде железо интенсивно корродирует; при обильном доступе кислорода образуются гидратные формы оксида железа (III):
2Fe + 3/2O2 + nH2O = Fe2O3×H2O.
При недостатке кислорода или при затрудненном доступе образуется смешанный оксид (II, III) Fe3O4:
3Fe + 4H2O(v) ↔ Fe3O4 + 4H2.
Железо растворяется в соляной кислоте любой концентрации:
Fe + 2HCl = FeCl2 + H2.
Аналогично происходит растворение в разбавленной серной кислоте:
Fe + H2SO4 = FeSO4 + H2.
В концентрированных растворах серной кислоты железо окисляется до железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
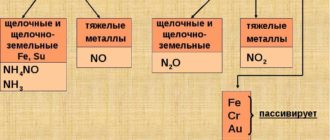
Однако, в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействия практически не происходит. В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:
Fe + 4HNO3 = Fe(NO3)3 + NO +2H2O.
При высоких концентрациях азотной кислоты растворение замедляется и железо становится пассивным.
Как и другие металлы железо вступает в реакции с простыми веществами. Реакции взаимодействия железа с галогенами (вне зависимости от типа галогена) протекают при нагревании. Взаимодействие железа с бромом протекает при повышенном давлении паров последнего:
2Fe + 3Cl2 = 2FeCl3;
2Fe + Br2 = 2FeBr3;
3Fe + 4I2 = Fe3I8.
Взаимодействие железа с серой (порошок), азотом и фосфором также происходит при нагревании:
Fe + S = FeS;
6Fe + N2 = 2Fe3N;
Fe + P = FeP;
2Fe + P = Fe2P;
3Fe + P = Fe3P.
Железо способно реагировать с такими неметаллами, как углерод и кремний:
3Fe + C = Fe3C;
Fe + Si = FeSi.
Среди реакций взаимодействия железа со сложными веществами особую роль играют следующие реакции — железо способно восстанавливать металлы, стоящие в ряду активности правее него, из растворов солей (1), восстанавливать соединения железа (III) (2):
Fe + CuSO4 = FeSO4 + Cu (1);
Fe + 2FeCl3 = 3FeCl2 (2).
Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
Железо при отсутствии примесей устойчиво в воде и в разбавленных растворах щелочей.
Получение железа
Основной способ получения железа – из железной руды (гематит, магнетит) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/svojstva-po-ximii/fizicheskie-i-ximicheskie-svojstva-zheleza/