Химические и физические свойства меди
Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.
Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.
В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди
Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
- оксид (I) – Cu2O,
- сульфид (I) – С
Двухвалентной
Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
Трехвалентной
Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
- оксид (III) – Cu2O3,
- купрат (III).
Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Источник: https://tvercult.ru/nauka/himicheskie-i-fizicheskie-svoystva-medi
Взаимодействует ли медь с водой — Справочник металлиста
В основе химических свойств большинства элементов лежит их способность к растворению в водной среде и кислотах. Изучение характеристики меди связано с малоактивным действием в обычных условиях.
Особенностью её химических процессов является образование соединений с аммиаком, ртутью, азотной и серной кислотами. Низкая растворимость меди в воде не способна вызвать коррозионные процессы.
Ей присущи особые химические свойства, позволяющие использовать соединение в разных отраслях промышленности.
Описание элемента
Медь считается старейшим из металлов, который научились добывать люди ещё до нашей эры. Это вещество получают из природных источников в виде руды. Медью называют элемент химической таблицы с латинским наименованием cuprum, порядковый номер которого равен 29. В периодической системе он расположен в четвёртом периоде и относится к первой группе.
Природное вещество является розово-красным тяжёлым металлом с мягкой и ковкой структурой. Температура его кипения и плавления – более 1000 °С. Считается хорошим проводником.
Химическое строение и свойства
Если изучить электронную формулу медного атома, то можно обнаружить, что у него имеется 4 уровня. На валентной 4s-орбитали находится всего один электрон. Во время химических реакций от атома может отщепляться от 1 до 3 отрицательно заряжённых частиц, тогда получаются соединения меди со степенью окисления +3, +2, +1. Наибольшей устойчивостью обладают её двухвалентные производные.
В химических реакциях она выступает в качестве малоактивного металла. В обычных условиях растворимость меди в воде отсутствует. В сухом воздухе не наблюдается коррозия, зато при нагревании поверхность металла покрывается чёрным налётом из оксида двухвалентного.
Химическая устойчивость меди проявляется при действии безводных газов, углерода, ряда органических соединений, фенольных смол и спиртов. Для неё характерны реакции комплексообразования с выделением окрашенных соединений.
Медь обладает небольшим сходством с металлами щелочной группы, связанным с формированием производных одновалентного ряда.
Это процесс образования однородных систем в виде растворов при взаимодействии одного соединения с другими веществами. Их составляющими являются отдельные молекулы, атомы, ионы и другие частицы. Степень растворимости определяется по концентрации вещества, которое растворили при получении насыщенного раствора.
Единицей измерения чаще всего являются проценты, объёмные или весовые доли. Растворимость меди в воде, как и других соединений твёрдого вида, подчиняется лишь изменениям температурных условий. Эту зависимость выражают с помощью кривых. Если показатель очень маленький, то вещество считается нерастворимым.
Растворимость меди в водной среде
Металл проявляет коррозионную стойкость под действием морской воды. Это доказывает его инертность в обычных условиях. Растворимость меди в воде (пресной) практически не наблюдается. Зато во влажной среде и под действием углекислого газа на металлической поверхности происходит образование плёнки зелёного цвета, которая является основным карбонатом:
Cu + Cu + O2 + H2O + CO2 → Cu(OH)2 · CuCO2.
Если рассматривать её одновалентные соединения в виде соли, то наблюдается их незначительное растворение. Такие вещества подвержены быстрому окислению. В результате получаются соединения меди двухвалентные. Эти соли обладают хорошей растворимостью в водной среде. Происходит их полная диссоциация на ионы.
Растворимость в кислотах
Обычные условия протекания реакций меди со слабыми или разбавленными кислотами не способствуют их взаимодействию. Не наблюдается химический процесс металла со щелочами. Растворимость меди в кислотах возможна, если они являются сильными окислителями. Только в этом случае протекает взаимодействие.
Растворимость меди в азотной кислоте
Такая реакция возможна ввиду того, что происходит процесс окисления металла сильным реагентом. Кислота азотная в разбавленном и концентрированном виде проявляет окислительные свойства с растворением меди.
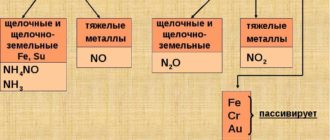
В первом варианте во время реакции получается меди нитрат и азота двухвалентный оксид в соотношении 75 % к 25 %. Процесс с разбавленной кислотой азотной можно описать следующим уравнением:
8HNO3 + 3Cu → 3Cu(NO3)2 + NO + NO + 4H2O.
Во втором случае получается меди нитрат и азота оксиды двухвалентные и четырёхвалентные, соотношение которых 1 к 1. В этом процессе участвует 1 моль металла и 3 моля кислоты азотной концентрированной. При растворении меди происходит сильный разогрев раствора, в результате чего наблюдается термическое разложение окислителя и выделение дополнительного объёма азотных оксидов:
4HNO3 + Cu → Cu(NO3)2 + NO2 + NO2 + 2H2O.
Реакцию используют в малотоннажном производстве, связанном с переработкой лома или удалением покрытия с отходов. Однако такой способ растворения меди имеет ряд недостатков, связанных с выделением большого количества азотных оксидов. Для их улавливания или нейтрализации необходимо специальное оборудование. Процессы эти весьма затратные.
Растворение меди считается завершённым, когда происходит полное прекращение выработки летучих азотистых оксидов. Температура реакции колеблется от 60 до 70 °C. Следующим этапом является спуск раствора из химического реактора. На его дне остаются небольшие куски металла, который не прореагировал. К полученной жидкости добавляют воду и проводят фильтрацию.
Растворимость в кислоте серной
В обычном состоянии такая реакция не протекает. Фактором, определяющим растворение меди в серной кислоте, является её сильная концентрация. Разбавленная среда не может окислить металл. Растворение меди в серной кислоте концентрированной протекает с выделением сульфата.
Процесс выражается следующим уравнением:
Cu + H2SO4 + H2SO4 → CuSO4 + 2H2O + SO2.
Свойства сульфата меди
Соль двухосновную ещё называют сернокислой, обозначают её так: CuSO4. Она представляет собой вещество без характерного запаха, не проявляющее летучесть. В безводной форме соль не имеет цвета, она непрозрачная, обладающая высокой гигроскопичностью. У меди (сульфат) растворимость хорошая. Молекулы воды, присоединяясь к соли, могут образовывать кристаллогидратные соединения. Примером служит купорос медный, который является пентагидратом голубого цвета. Его формула: CuSO4·5H2O.
Кристаллогидратам присуща прозрачная структура синеватого оттенка, они проявляют горьковатый, металлический привкус. Молекулы их способны со временем терять связанную воду. В природе встречаются в виде минералов, к которым относят халькантит и бутит.
Горелка для пайки медных труб твердым припоем
Подвержен воздействию меди сульфат. Растворимость является реакцией экзотермической. В процессе гидратации соли выделяется значительное количество тепла.
Растворимость меди в железе
В результате этого процесса образуются псевдосплавы из Fe и Cu. Для металлического железа и меди возможна ограниченная взаимная растворимость. Максимальные её значения наблюдаются при температурном показателе 1099,85 °C. Степень растворимости меди в твёрдой форме железа равняется 8,5 %. Это небольшие показатели. Растворение металлического железа в твёрдой форме меди составляет около 4,2 %.
Снижение температуры до комнатных значений делает взаимные процессы незначительными. При расплавлении металлической меди, она способна хорошо смачивать железо в твёрдой форме. При получении псевдосплавов Fe и Cu используют особые заготовки. Их создают путём прессования или печения железного порошка, находящегося в чистой или легированной форме. Такие заготовки пропитывают жидкой медью, образуя псевдосплавы.
Растворение в аммиаке
Процесс часто протекает при пропускании NH3 в газообразной форме над раскалённым металлом. Результатом является растворение меди в аммиаке, выделение Cu3N. Это соединение называют нитридом одновалентным.
Соли её подвергаются воздействию раствора аммиачного. Прибавление такого реактива к медному хлориду приводит к выпадению осадка в виде гидроксида:
CuCl2 + NH3 + NH3 + 2H2O → 2NH4Cl + Cu(OH)2↓.
Аммиачный избыток способствует формированию соединения комплексного типа, имеющего окраску тёмно-синюю:
Cu(OH)2↓+ 4NH3 → [Cu(NH3)4] (OH)2.
Этот процесс используют для определения ионов двухвалентной меди.
Растворимость в чугуне
В структуре ковкого перлитного чугуна помимо основных компонентов присутствует дополнительный элемент в виде обычной меди. Именно она повышает графитизацию углеродных атомов, способствует увеличению жидкотекучести, прочности и твёрдости сплавов.
Металл положительно влияет на уровень перлита в конечном продукте. Растворимость меди в чугуне используют для проведения легирования исходного состава. Основной целью такого процесса является получение ковкого сплава.
У него будут повышенные механические и коррозионные свойства, но уменьшено охрупчивание.
Если содержание меди в чугуне составляет около 1 %, то показатель прочности при проведении растяжения приравнивается к 40 %, а текучести увеличивается до 50 %. Это существенно изменяет характеристики сплава.
Повышение количества металла, легирующего до 2 %, приводит к изменению прочности до значения 65 %, а показатель текучести становится равен 70 %. При большем содержании меди в составе чугуна труднее образуется шаровидный графит. Введение в структуру легирующего элемента не изменяет технологию формирования вязкого и мягкого сплава.
Время, которое отводится для отжига, совпадает с продолжительностью такой реакции при производстве чугуна без примеси меди. Оно составляет около 10 часов.
Использование меди для изготовления чугуна с высокой концентрацией кремния не способно полностью устранить так называемое ожелезнение смеси во время отжига. В результате получают продукт с низкой упругостью.
Растворимость в ртути
При смешивании ртути с металлами других элементов получаются амальгамы. Этот процесс может проходить при комнатной температуре, ведь в таких условиях Pb представляет собой жидкость.
Растворимость меди в ртути проходит только во время нагревания. Металл необходимо предварительно измельчить. При смачивании жидкой ртутью твёрдой меди происходит взаимное проникновение одного вещества в другое или процесс диффундирования.
Значение растворимости выражается в процентах и составляет 7,4*10-3.
В процессе реакции получается твёрдая простая амальгама, похожая на цемент. Если её немного нагреть, то она размягчается. В результате такую смесь используют для починки изделий из фарфора. Существуют ещё и сложные амальгамы с оптимальным содержанием в ней металлов. Например, в стоматологическом сплаве присутствуют элементы серебра, олова, меди и цинка. Их количество в процентах относится как 65: 27: 6:2. Амальгам с таким составом называется серебряным.
Каждый компонент сплава выполняет определённую функцию, которая позволяет получить пломбу высокого качества.
Для приготовления амальгамы желательно использовать инертную атмосферу или защитную жидкость, которая образует плёнку. Металлы, входящие в состав сплава способны быстро окисляться воздухом. Процесс нагревания амальгамы купрума в присутствие водорода приводит к отгонке ртути, что позволяет отделить элементарную медь. Как видите, эта тема несложна для изучения.
Теперь вы знаете, как медь взаимодействует не только с водой, но и с кислотами и другими элементами.
Источник: https://ssk2121.com/vzaimodeystvuet-li-med-s-vodoy/