Медь самородная формула свойства
Синонимы: Купрокупритом были названы тонкие смеси самородной меди и куприта (Вернадский, 1910). Витнеит—whitneyite (Гент, 1859) и дарвинит (Форбс, 1860) — мышьяковистая медь, образующая смеси с альгодонитом.
Группа
Происхождение названия
Латинское наименование меди cuprum происходит от названия острова Кипр, откуда в древности ввозили медь. Происхождение русского названия неясно.
Английское название минерала Медь — Copper
Медный самородок
- Химический состав
- Разновидности
- Кристаллографическая характеристика
- Форма нахождения в природе
- Физические свойства
- Химические свойства. Прочие свойства
- Диагностические признаки. Спутники.
- Происхождение минерала
- Месторождения
- Практическое применение
- Физические методы исследования
- Кристаллооптические свойства в тонких препаратах (шлифах)
- Купить
Химический состав
Содержит иногда примеси Fe, Ag, Pb, Au, Hg, Bi, Sb, V, Ge3 (серебристая медь с 3—4% Ag, железистая—2,5% Fe и золотистая—2—3% Au). Примеси наблюдаются чаще в первичной самородной меди; вторичная медь обычно более чистая. Состав самородной меди из Шамлугского месторождения (Армения): Cu — 97,20 —97,46%, Fe — 0,25%; в меди из месторождений Алтая определено 98,3% Cu и более.
Кристаллографическая характеристика
Сингония. Кубическая.
Класс. Гексоктаэдрический.
Кристаллическая структура
Для кристаллической структуры характерна гранецентрированная решетка; по углам и в центрах граней элементарного куба расположены атомы меди.
Это формальное выражение того, что в структуре меди имеется плотнейшая упаковка (так называемая кубическая плотнейшая упаковка) из атомов металла с радиусом 1,27 А и расстоянием между ближайшими атомами 2,54 А при выполнении пространства в 74,05%.
Каждый атом Cu окружен 12 ему подобными (координационное число 12), располагающимися вокруг него по вершинам так называемого Архимедова кубооктаэдра.
Главные формы:а (100), d (110), о (111), l (530), е (210), h (410).
Форма нахождения в природе
Облик кристаллов. Облик кристаллов кубический, тетрагексаэдрический, додекаэдрический, реже — октаэдрический (возможно, псевдоморфозы по куприту). Грани часто шероховатые, с углублениями или возвышениями. Простые кристаллы редки.
Двойники. Двойники срастания по (111) обычны, иногда полисинтетические, часто пластинчатые в направлении двойники оси или удлиненные паралелльны диагонали двойники плоскости. Обычно кристаллы (простые и двойники) неравномерно развиты: вытянуты, укорочены или деформированы.
Характерны дендритовидные формы, представляющие собой однообразные срастания множества кристаллов (единообразно деформированных или правильных) по какому-либо одному направлению.
Таковы, например, двойниковые по (111) кристаллы, вытянутые по оси симметрии 2-го порядка и сросшиеся параллельно граням ромбического додекаэдра) или срастания правильных двойниковых кристаллов, разветвляющиеся по направлению ребер и диагоналей октаэдрических граней, а также параллельные срастания кристаллов, вытянутых в направлении осей 4-го порядка. В сплошных выделениях самородной меди при травлении обнаруживаются признаки собирательной кристаллизации с развитием крупных зерен за счет более мелких зональных зерен неправильной формы.
Агрегаты. Искаженные кристаллы, в одиночных неправильных зернах, дендритовидные сростки, нитевидные, проволочные, моховидные образования, тонкие пластинки, конкреции, порошковатые скопления и сплошные массы весом до нескольких сотен тонн.
Дендриты
Оптические
Цвет в свежем изломе светло-розовый, быстро переходящий в медно-красный, затем в коричневый; часто с желтой или пестрой побежалостью.
Черта медно-красная, блестящая.
Блеск металлический.
Отлив
Прозрачность. Непрозрачна. В тончайших пластинках просвечивает зеленым цветом.
Показатели преломления
Ng = , Nm = и Np =
Механические
Твердость 2,5-3.
Плотность 8,4—8,9
Спайность не наблюдается.
Излом занозистый, крючковатый.
Химические свойства
Легко растворяется в разбавленной HNO3 и в царской водке, в H2SO4— при нагревании, в НСl — с трудом. В водном растворе аммиака растворяется, окрашивая его в синий цвет. В полированных шлифах травится всеми основными реактивами. Внутреннее строение легко выявляется с помощью NH4OH + Н2O2 или НСl+ CrO3 (50%-ный раствор).
Прочие свойства
Очень ковка и тягуча. Электропроводность очень высокая; существенно понижается от примесей.
Поведение при нагревании. Чистая медь плавится при 1083°. Теплопроводность несколько меньше, чем у серебра.
Искусственное получение минерала
Может быть легко получена из расплавов или путем электролиза из растворов солей меди.
Диагностические признаки
Сходные минералы
Узнается по красному цвету свежей поверхности, блестящей черте, средней твердости и ковкости, обычно покрыта зеленоватыми, черными, синими налетами окисленных минералов меди. Под микроскопом в отраженном свете легко определяется по цвету и отражательной способности.
Сопутствующие минералы. Медистое золото, халькозин, кальцит, диопсид, апатит, сфен, магнетит, малахит, барит, кварц, халькопирит.
Происхождение и нахождение
Гидротермальное. Накапливается в россыпях. Как уникальные явления описаны самородки массой до 450 т.
Самородная медь образуется в восстановительных условиях при различных геологических процессах; значительная часть ее выделяется из гидротермальных растворов. В виде микроскопических выделений наблюдается во многих, преимущественно основных, изверженных породах, подвергшихся воздействию гидротермальных растворов, например, в серпентинизированных перидотитах, дунитах и серпентинитах.
В этом случае возникновение самородной меди, возможно, связано с разложением ранее образовавшихся медных сульфидов, например, кубанита (Урал, Закавказье). Аналогичное происхождение можно приписать самородной меди в амфиболитизированных основных породах Серовского района Свердловской области.
В Карабашском месторождении медистого золота Челябинской области самородная медь наблюдается в жилообразных телах диопсидо-гранатовых пород, залегающих среди серпентинитов; для самородной меди здесь характерна ассоциация с медистым золотом, халькозином, кальцитом, диопсидом, апатитом, сфеном, магнетитом и др.
В некоторых древних вулканических породах (мелафирах, диабазах и др.
), метаморфизованных под воздействием паров, газов и гидротермальных растворов, медь выполняет миндалины, образует цемент между минералами измененной лавы, заполняет пустоты и трещины; сопровождается гидротермальными минералами: анальцимом, ломонтитом, пренитом, датолитом, адуляром, хлоритом, эпидотом, пумпелиитом, кварцем, кальцитом.
Крупнейшие месторождения этого типа находятся на полуострове Кивино в районе Верхнего озера (штат Мичиган, США), где оруденение приурочено к верхнепротерозойской толще. масса меди добывается из мелафиров и конгломератов, но наиболее крупные выделения меди (до 400 т и более) встречены в кальцитовых жилах, содержащих самородное серебро и домейкит.
Медный самородок
Изменение минерала
Наиболее обычными продуктами изменения самородной меди являются куприт, малахит и азурит.
Месторождения
Выделения самородной меди наблюдались в диабазах Новой Земли, в траппах Сибирской платформы, среди основных эффузивных пород в Италии, на Фарерских островах (Дания), в Новой Шотландии (Канада) и в других местах. Представителями редких типов гипогенных месторождений самородной меди являются цинково-марганцовое месторождение Франклин (штат Нью-Джерси, США) и марганцовые месторождения Лонгбан и Якобсберг (Швеция).
Гипогенными, по-видимому, являются выделения самородной меди весом до нескольких тонн из ранее разрабатывавшегося месторождения Калмактас в Казахстане, представленные в музеях прекрасными образцами.В зоне окисления, особенно в ее нижних частях, самородная медь в основном является ранним продуктом изменения сульфидных медных минералов, главным образом халькозина.
Она слагает преимущественно выделения неправильной формы, реже — кристаллы и дендритовидные агрегаты.Наиболее часто самородная медь сопровождается халькозином, купритом, кальцитом, лимонитом. Наблюдается в ряде месторождений Казахстана (Джезказган, Беркара, Успенское и др.), Рудного Алтая (Белоусовское, Зыряновское, Чудак, Таловское и др.), США (Бисби и Клифтон- Моренси в штате Аризона, Тинтик в штате Юта и др.).
Частью самородная медь в зоне окисления возникает путем отложения из растворов, содержащих сульфат меди. Такова, например, самородная медь, образующая выделения в полостях среди агрегатов лимонита, иногда в ассоциации с купритом (Меднорудянекое месторождение Свердловской обл. и др.).
Известны псевдоморфозы самородной меди, образовавшиеся в зоне окисления по халькозину, куприту, антлериту, халькантиту, азуриту, кальциту, арагониту и другим минералам.Особенно красивые образцы самородной меди (кристаллы и дендритовидные сростки) происходят из Турьинских рудников Свердловской области.
В некоторых горных выработках из медьсодержащих вод на железных предметах выделяется так называемая цементная медь в виде пленок и корочек. Известны также случаи образования меди на полусгнивших остатках крепежной древесины.
В повышенном количестве самородная медь наблюдается в некоторых осадочных породах (песчаниках, глинах, мергелях), содержащих растительные остатки, в виде выделений неправильной формы, иногда в псевдоморфозах по древесине или в виде конкреций. Таковы, например, пермские медистые песчаники отдельных районов России (Приуралье, Татарстан и др.), песчаники Науката в Киргизияи меловые медистые песчаники Корокоро и Кобрицос в Боливии и др.С восстановительными процессами связано также образование самородной меди в некоторых торфяниках, например,в Свердловской области— по реке Лёвихе в бассейне реки Тагила и в Сысертском районе.
В виде галек и зерен самородная медь встречается в России в некоторых россыпях: на Урале, по Енисею, по реке Б. Сархой в Бурятия, по реке Чорох в Грузии, на Командорских островах и в других местах. В штате Коннектикут (США) самородная медь обнаружена в ледниковых отложениях в виде выделений весом до 75 кг. Мелкие, неправильной формы выделения самородной меди отмечены в самородном железе метеорита Венгерово в ассоциации с троилитом.
Источник: https://natural-museum.ru/mineral/%D0%BC%D0%B5%D0%B4%D1%8C
Польза и вред меди для организма, в каких продуктах содержится
Польза и вред меди были доказаны еще в античное время. Без этого элемента невозможно поддержание нормального уровня жизнедеятельности, он необходим для организма. С другой стороны, медь может принести вред и стать причиной серьезных заболеваний.
Описание вещества
Медь (Cuprum) – металл, известный с древних времен. Вещество очень пластично, цвет – розовое золото. В процессе окисления приобретает красноватый оттенок и покрывается пленкой. Чистая медь является хорошим проводником тепла, электричества.
В таблице Менделеева она занимает 29-е место, находится в 4-м периоде. Она расположилась в группе с благородными металлами.
Полезные свойства меди
Медь для организма человека несет огромную пользу. Это заметили еще в древние времена. В Риме, Греции и других странах использовали методы лечения медными монетами.
Сегодня металл используется как средство:
- противовоспалительное;
- антибактериальное;
- кровоостанавливающее;
- жаропонижающее.
Лечение способно помочь при:
- остановке кровотечений;
- рассасывании новообразований доброкачественного характера;
- снятии болей;
- поражении миндалин – тонзиллите и ангине;
- головной боли;
- гайморите;
- болезнях сердечно-сосудистой системы;
- укреплении иммунной системы;
- варикозном расширении вен.
Кроме того, элемент принимает участие в производстве эритроцитов. Он важен при синтезировании гемоглобина. Укрепляет стенки сосудов и капилляров, влияет на пигментацию, отвечает за прочность костной ткани.
Продукты-источники меди
В каких продуктах содержится медь? Ведь именно из пищи организм получает этот элемент. Список продуктов действительно разнообразен. Большинство специалистов предлагает разделить продукты на две группы: растительного происхождения и животного.
Важно! Количество меди в конкретном продукте зависит от ее количества в почве.
Растительного происхождения
Рекордсменами по содержанию элемента являются злаки. Можно употреблять любые виды: семена подсолнечника, тыквы, льна. Высокое содержание зафиксировано в крупах — перловая крупа, кускус, булгур, рис, и кашах — овсяная, гречневая, манная.
Медь есть в продуктах, содержащих муку. Например, в выпечке. Однако сдобная выпечка является источником большого количества сахара и жира. Лучше выбирать хлеб из твердых сортов и из цельнозерновой муки.
К продуктам, содержащим элемент, относятся фрукты и ягоды. Из фруктов наибольшим содержанием меди характеризуются абрикосы, бананы, виноград, ананасы и т. д. Большое количество содержит малина, клубника, вишня, черная смородина, клюква.
Сухофрукты и орехи также богаты медью:
- изюм;
- курага;
- чернослив;
- финики;
- фундук;
- бобы какао.
Содержится в зелени и пряностях. Например, в укропе, шпинате, имбире.
Животного происхождения
Многие ученые утверждают, что больше всего металла содержится в морепродуктах. Дары моря с древних времен считались богатейшим источником элемента. Необходимо употреблять креветки, кальмары, мидии, ракообразные и все сорта рыбы. Более того, морепродукты содержат белок, калий, никель, витамины группы А и D.
К сожалению, морепродукты могут нанести немалый вред. Следует выбирать только свежие продукты, просроченные могут вызвать отравление.
Медь есть в мясе. Необходимо употреблять все виды мяса и птицы. 97 мкг меди содержится в свинине, это наибольшее значение. Субпродукты также обогащены металлом.
Суточная потребность и норма содержания меди в организме
Медь имеет пользу и вред для здоровья человека. К сожалению, человеческий организм не синтезирует металл самостоятельно, поэтому необходимо пополнять запасы. Суточная потребность и норма содержания отличаются в зависимости от некоторых факторов:
- пола;
- возраста;
- индивидуальных особенностей.
Для взрослых
Тело взрослого человека содержит около 140-160 мг меди. Эта цифра может меняться в зависимости от индивидуальных особенностей.
Для поддержания нормального уровня жизнедеятельности следует употреблять от 2 до 3 мг элемента в сутки. Половина этого количества необходима для костной системы и мышц, около 12% для работы печени.
Исследования, проведенные в данной области, утверждают, что большинство взрослых людей употребляют недостаточное количество меди. Чаще всего человек съедает чуть больше 1 мг в день.
Для детей
Для детей норма содержания напрямую зависит от возраста:
- От 1 до 3 лет – не более 1 мг.
- От 4 до 6 лет – 1,5 мг.
- От 7 до 13 лет – 2 мг.
- До 18 лет – до 2,5 мг.
Не стоит давать ребенку слишком много продуктов, содержащих этот металл, это может вызвать отравление.
Внимание! Перед употреблением препаратов, поднимающих содержание меди, необходимо проконсультироваться со специалистом.
При беременности
Во время беременности женщине необходимо больше микроэлементов, витаминов и полезных веществ. Женский организм работает за двоих. Полезные свойства меди делают ее необычайно важным элементом во время беременности. Потребность в ней возрастает. Польза меди для организма женщины огромна.
В день беременной даме следует употреблять до 2,5 мг меди.
Норма содержания в организме отличается на каждом триместре. На первом триместре она составляет 110-200 мг, на втором 160-225 мг, на третьем 131-245 мг.
Причины и симптомы недостатка меди в организме
Для того чтобы не столкнуться с недостатком меди, человеку достаточно съедать 100-120 грамм мяса в день, небольшое количество круп и фруктов. Однако многие все же страдают от дефицита меди в организме, к наиболее распространенным причинам относятся:
- Наследственная предрасположенность. Существуют генетические заболевания, при которых люди страдают от дефицита ферментов, что приводит к пониженному содержанию элемента.
- Скудное питание. Очень часто, особенно в подростковом возрасте, люди предпочитают вредные продукты полезным. В рацион входят сладости, чипсы, газировка и т. д.
- У малышей дефицит полезного элемента встречается при слишком раннем введении прикорма или неправильном вскармливании. При грудном вскармливании ребенок получает все необходимое из молока. Смесь не содержит достаточного количества полезных элементов. Кроме того, она может быть некачественной. Попытки кормить ребенка «взрослой едой» также провоцируют развитие дефицита металла.
- Заболевания ЖКТ, при которых нарушается нормальное всасывание элемента.
- Заболевания печени и почек.
- Неправильное питание вследствие диет. Здоровый образ жизни очень популярен, но многие придерживаются «псевдоправил» здорового питания и не получают достаточного количества металла.
К основным симптомам недостатка относятся:
- слабость и повышенная утомляемость;
- выпадение волос или появление седины;
- головные боли или головокружения;
- частые простудные и инфекционные заболевания.
Важно! Если человек заметил данные симптомы, не стоит откладывать визит к врачу, это может нанести серьезный вред.
Симптомы и последствия избытка меди в организме
Избыток металла в организме может возникать по нескольким причинам: нарушение обмена веществ, отравление парами металла, передозировка лекарствами. Самая частая причина — употребление слишком большого количества продуктов, содержащих элемент.
Основные симптомы избытка:
- тошнота, рвота;
- спазмы в животе или диарея;
- привкус металла во рту;
- нарушения неврологического характера;
- повышенная температура тела;
- приступы жажды;
- озноб.
При появлении симптомов стоит незамедлительно обратиться к врачу. Последствия могут быть по-настоящему опасны и принести вред организму. Список последствий:
- нарушения речи;
- психоз;
- атеросклероз;
- диабет;
- болезнь Альцгеймера.
Препараты, содержащие медь
Не стоит заниматься самолечением и пытаться восполнить дефицит меди самостоятельно. Употребление любого лекарства должно быть согласовано с врачом. Список препаратов, которые может предложить специалист, огромен:
- Био-медь;
- Купратин;
- Цинктерал;
- Купрал;
- Цинктерал-Тева;
- Компливит;
- ЦиМед;
- Тотема.
Взаимодействие меди с другими веществами
Усвоение меди снижает: кадмий, железо, марганец, антациды, танины. Цинк, железо, кобальт, напротив, повышают усвоение.
Медь может затормаживать всасывание железа. Большое количество фруктозы отрицательно влияет на всасывание этого элемента. Употребление большого количества овощей и фруктов, содержащих витамин С, или препаратов способно вызвать дефицит металла.
Польза и вред медной посуды
Медная посуда имеет высокую теплопроводность, блюда в ней готовятся быстрее. При этом вкусовые качества не ухудшаются, а, напротив, улучшаются. Некоторые варенья или соусы рекомендуют готовить именно в посуде из этого металла.
За счет уменьшения времени приготовления продукт сохраняет максимум полезных свойств. Именно поэтому посуда из меди несет пользу организму. Еще одно полезное свойство – антибактериальное действие.
С другой стороны, такая посуда приносит вред здоровью:
- под воздействие меди разрушается аскорбиновая кислота;
- при хранении в данной посуде происходит окисление;
- в ненадлежащих условиях покрывается зеленым налетом и вырабатывает вредные вещества.
Польза медной воды
Это вода, которая настоялась в медной посуде. Такое лекарство применяют с древних времен, оно используется в аюрведе. Вода в медной посуде может принести пользу при правильном употреблении. Лучше настаивать лекарство не более 12 часов. После приготовления выпивать натощак по 1 стакану. Используется:
- при проблемах с ЖКТ;
- при заболеваниях печени и почек;
- для замедления процессов старения;
- при заболеваниях сердечно-сосудистой системы;
- при проблемах с нервной системой и головным мозгом;
- при анемии;
- при воспалении суставов.
Вред меди и противопоказания
Хотя медь имеет массу полезных свойств, она может принести серьезный вред. Избыток вызывает различные заболевания, боли в мышцах, нарушения сна, провоцирует развитие эпилепсии, разрушает клетки, замедляет процессы роста, повышает уровень холестерина. Лечение металлом противопоказано при индивидуальной непереносимости.
Заключение
Польза и вред меди доказаны. Она жизненно необходима организму, приносит огромную пользу здоровью. Ее употребление должно быть нормировано. Особенно важно съедать достаточное количество продуктов, обогащенных этим металлом, при беременности и дефиците меди.
Была ли Вам данная статья полезной?
Источник: https://poleznii-site.ru/meditsina/chem-polezna-i-vredna-med-dlya-organizma.html
Какими свойствами обладает медь
В большей части промышленных отраслей используется такой металл, как медь.
Благодаря высокой электропроводности без этого материала не обходится ни одна область электротехники.
Из нее образуются проводники, обладающими отличными эксплуатационными особенностями.
Помимо этих особенностей медь обладает пластичностью и тугоплавкостью, устойчивостью к коррозии и агрессивным средам. И сегодня мы рассмотрим металл со всех сторон: укажем цену за 1 кг лома меди, поведаем о ее использовании и производстве.
Медь представляет собой химический элемент, носящийся к первой группы периодической системы имени Менделеева.
Этот пластичный металл имеет золотисто – розовый цвет и является одним из трех металлов с ярко выраженным окрашиванием.
С давних времен активно используется человеком во многих областях промышленности.
Главной особенностью металла является его высокая электро- и теплопроводность. Если сравнивать с другими металлами, то проведение электрического тока через медь выше в 1,7 раз, чем у алюминия, и почти в 6 раз выше, чем у железа.
Медь имеет ряд отличительных особенностей перед остальными металлами:
- Пластичность. Медь представляет собой мягкий и пластичный металл. Если брать во внимание медную проволоку, она легко гнется, принимает любые положения и при этом не деформируется. Сам же металл достаточно немного надавить, чтобы проверить эту особенность.
- Устойчивость к коррозии. Этот фоточувствительный материал отличается высокой устойчивостью к возникновению коррозии. Если медь на длительный срок оставить во влажной среде, на ее поверхности начнет появляться зеленая пленка, которая и защищает металл от негативного влияния влаги.
- Реакция на повышение температуры. Отличить медь от других металлов можно путем ее нагревания. В процессе медь начнет терять свой цвет, а затем становиться темнее. В результате при нагреве металла он достигнет черного цвета.
Благодаря таким особенностям можно отличить данный материал от латуни, олова, бронзы и других металлов.
ниже расскажет вам про полезные свойства меди:
Преимуществами данного металла являются:
- Высокий показатель теплопроводности;
- Устойчивость к влиянию коррозии;
- Достаточно высокая прочность;
- Высокая пластичность, которая сохраняется до температуры -269 градусов;
- Хорошая электропроводность;
- Возможность легирования с различными добавочными компонентами.
Про характеристики, физические и химические свойства вещества-металла меди и ее сплавов читайте ниже.
Свойства и характеристики
Медь, как малоактивный металл, не вступает во взаимодействие с водой, солями, щелочами, а также со слабой серной кислотой, но при этом подвержена растворению в концентрированной серной и азотной кислоте.
Физические свойства метала:
- Температура плавления меди составляет 1084°C;
- Температура кипения меди составляет 2560°C;
- Плотность 8890 кг/м³;
- Электрическая проводимость 58 МОм/м;
- Теплопроводность 390 м*К.
Механические свойства:
- Предел прочности на разрыв при деформированном состоянии составляет 350-450 МПа, при отожженном – 220-250 МПа;
- Относительное сужение в деформированном состоянии 40-60%, в отожженном – 70-80%;
- Относительное удлинение в деформированном состоянии составляет 5-6 δ ψ%, в отожженном – 45-50 δ ψ%;
- Твердость составляет в деформированном состоянии 90-110 НВ, в отожженном – 35-55 НВ.
При температуре ниже 0°С этот материал обладает более высокой прочностью и пластичностью, чем при +20°С.
Структура и состав
Медь, имеющая высокий коэффициент электропроводности, отличается наименьшим содержанием примесей. Доля их в составе может приравниваться 0,1%.
С целью увеличения прочности меди в нее добавляют различные примеси: сурьма, цинк, олово, никель и прочее.
В зависимости от ее состава и степени содержания чистой меди различают несколько ее марок.
Структурный тип меди может включать в себя также кристаллы серебра, никеля, кальция, алюминий, золота и других компонентов.
Все они отличаются сравнительной мягкостью и пластичностью. Частичка самой меди имеет кубическую форму, атому которой расположены на вершинах F –ячейки.
Каждая ячейка состоит из 4 атомов.
О том, где брать медь, смотрите в этом видеоролике:
В природных условиях данный металл содержится в самородной меди и сульфидных рудах.
Широкое распространение при производстве меди получили руды под названием «медный блеск» и «медный колчедан», которые содержат до 2% необходимого компонента.
Большую часть (до 90%) первичного металла меди получают благодаря пирометаллургическому способу, который включает в себя массу этапов: процесс обогащения, обжиг, плавка, обработка в конвертере и рафинирование. Оставшаяся часть получается гидрометаллургическим способом, который заключается в ее выщелачивании разведенной серной кислоты.
Медь активно используется в следующих областях:
- Электротехническая промышленность, которая заключается, в первую очередь, в производстве электропроводов. Для этих целей медь должна быть максимально чистой, без посторонних примесей.
- Изготовление филигранных изделий. Медная проволока в отожженном состоянии отличается высокой пластичностью и прочностью. Именно поэтому, она активно используется при производстве различных шнуров, орнаментов и прочих конструкций.
- Переплавка катодной меди в проволоку. Самые разнообразные медные изделия переплавляются в слитки, которые идеально подходят для дальнейшей прокатки.
Медь активно используется в самых различных сферах промышленности. Она может входить в состав не только проволоки, но и оружия и даже бижутерии. Ее свойства и широкая сфера применения благоприятно повлияли на ее популярность.
ниже расскажет о том, как медь может изменить свои свойства:
Источник: https://steelfactoryrus.com/kakimi-svoystvami-obladaet-med/
Медь свойства
Медь — свойства.
Физические, электрические и магнитные, тепловые и термодинамические, оптические, механические, химические, технологические свойства меди. Области применения меди.
Медь входит в состав более чем 200 минералов, однако лишь немногие из них (приблизительно 40) имеют промышленное значение. Важнейшие минералы, входящие в состав медных руд, халькозин, или медный блеск; халькопирит, или медный колчедан; малахит. Медные руды Д комплексное сырье, помимо меди, содержащее цинк, никель, молибден, кобальт и, кроме того, серу, селен, теллур, индий, германий, свинец, гадолиний, а также серебро и золото.
В настоящее время перерабатываются руды, содержащие от 0,7 до 3 % меди. Производство меди основано на переработке сульфидных и окисленных медных руд. Более 80 % меди получают пирометаллургическим методом, остальные 20 % Д методом гидрометаллургии. При пирометаллургическом методе руды предварительно обогащают, а затем концентрат подвергают собственно пирометаллургическому переделу, состоящему из обжига, плавки и конвертирования.
Получаемую черновую медь подвергают огневому или электролитическому рафинированию. Гидрометаллургическая переработка состоит в выщелачивании руды для перевода меди в раствор с последующим осаждением ее из раствора. Гидрометаллургическим методом перерабатывают главным образом бедные окисленные руды и самородную медь. Выщелачиванию подвергают руду в мелкораздробленном состоянии.
Реагентами процесса служат обычно раствор серной кислоты или аммиачные растворы. Осаждение меди из ее сернокислых растворов, полученных в результате выщелачивания, производится электролитическим способом (электролиз с нерастворимыми анодами) или цементацией (осаждение железом). При выщелачивании аммиачными растворами после разложения их острым паром медь выделяется в виде СuО.
Цементационная медь и медь, полученная разложением аммиачных растворов, поступает на рафинироваиие или переработку на специальные заводы.
Медь — металл розово-красного цвета, относится к группе тяжелых металлов, является отличным проводником тепла и электрического тока. Электропроводность меди в 1,7 раза выше, чем у алюминия, и в 6 раз выше, чем у железа. Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э.
существовали медные рудники и выплавлялась медь. Около II — III в. выплавка меди производилась в широком масштабе в Египте, в Месопотамии, на Кавказе, в других странах древнего мира.
Но, тем не менее, медь — далеко не самый распространенный в природе элемент: содержание меди в земной коре составляет 0,01%, а это лишь 23-е место среди всех встречающихся элементов.
В промышленном производстве и при ремонте узлов техники различного назначения широко применяются сплавы меди — бронза и латунь. По бронзовым сплавам — свойства бронзы, по сплавам меди с цинком (латунь) — свойства латуни, применение латуни.
Конечно, наиболее широко в современной промышленности распространено железо и его сплавы — стали, свойства чёрных металлов и свойства стали позволяют, ввиду их относительной дешевизны, во многом заменять более дорогие цветные металлы.
Свойства цветных металлов: Aluminium, copper, brass, bronze на английском языке.
Получение меди
В природе медь присутствует в виде сернистых соединений, оксидов, гидрокарбонатов, углекислых соединений, в составе сульфидных руд и самородной металлической меди. Наиболее распространенные руды — медный колчедан и медный блеск, содержащие 1-2 % меди. 90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим.
Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700-800°C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального.
Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига. После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа . Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах.
Температура в зоне плавки 1450°C. С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200-1300°C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива.
Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование).
Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7%. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинирование проводят для получения чистой меди (99,95% ).
Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг.
Их тщательно промывают, а затем переплавляют в электропечах. Кроме этого, существуют технологии получения меди из лома. В частности, путем огневого рафинирования из лома получают рафинированную медь.По чистоте медь делится на марки: М0 (99,95% Cu), М1 (99,9%), М2(99,7%), М3 (99,5%), М4 (99%). Химические свойства медиМедь — малоактивный металл, который не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой.
Однако, медь растворяется в сильных окислителях (например, азотной и концентрированной серной). Медь обладает достаточно высокой стойкостью к коррозии. Однако, во влажной атмосфере, содержащей углекислый газ, поверхность металла покрывается зеленоватым налетом (патиной). Основные физические свойства медиТемпература плавления °C1084Температура кипения °C2560Плотность, γ при 20°C, кг/м³8890Удельная теплоемкость при постоянном давлении, Ср при 20°C, кДж/(кг•Дж)385Температурный коэфициент линейного расширения, а•106 от 20 до 100°C, К-116,8Удельное электрическое сопротивление, р при 20°C, мкОм•м0,01724Теплопроводность λ при 20°C, Вт/(м•К)390Удельная электрическая проводимость, ω при 20°C, МОм/м58
Механические свойства меди
Свойства Состояние Деформированное ОтожженноеПредел прочности на разрыв, σ МПа340 — 450220 — 245Относительное удлинение после разрыва, δ ψ%4 — 645 — 55Относительное сужение, после разрыва, %40 — 6065 — 80Твердость по Бринеллю, НВ90 — 11035 — 55При отрицательных температурах медь имеет более высокие прочностные свойства и более высокую пластичность, чем при температуре 20°С. Признаков холодноломкости техническая медь не имеет. С понижением температуры увеличивается предел текучести меди и резко возрастает сопротивление пластической деформации. Применение меди
Такие свойства меди, как электропроводность и теплопроводность, обусловили основную область применения меди — электротехническая промышленность, в частности, для изготовления проводов, электродов и т. д. Для этой цели применяется чистый металл (99,98-99,999%), прошедший электролитическое рафинирование.
Медь обладает многочисленными уникальными свойствами: устойчивостью к коррозии, хорошей технологичностью, достаточно долгим сроком службы, прекрасно сочетается с деревом, природным камнем, кирпичом и стеклом. Благодаря своим уникальным свойствам, с древнейших времен этот металл используется в строительстве: для кровли, украшения фасадов зданий. Срок службы медных строительных конструкций исчисляется сотнями лет.
Кроме этого, из меди изготовлены детали химической аппаратуры и инструмент для работы с взрывоопасными или легковоспламеняющимися веществами. Очень важная область применения меди — производство сплавов. Один из самых полезных и наиболее употребляемых сплавов — латунь (или желтая медь). Ее главные составные части: медь и цинк. Добавки других элементов позволяют получать латуни с самыми разнообразными свойствами.
Латунь тверже меди, она ковкая и вязкая, потому легко прокатывается в тонкие листы или выштамповывается в самые разнообразные формы. Одна беда: она со временем чернеет. С древнейших времен известна бронза. Интересно, что бронза более легкоплавка по сравнению с медью, но по своей твердости превосходит отдельно взятые чистые медь и олово.
Если еще 30-40 лет назад бронзой называли только сплавы меди с оловом, то сегодня уже известны алюминиевые, свинцовые, кремниевые, марганцевые, бериллиевые, кадмиевые, хромовые, циркониевые бронзы. Медные сплавы, так же как и чистая медь, с давних пор используются для производства различных орудий, посуды, применяются в архитектуре и искусстве. Медные чеканки и бронзовые статуи украшали жилище людей с древних времен.
До наших дней сохранились изделия из бронзы мастеров Древнего Египта, Греции, Китая. Большими мастерами в области бронзового литья были японцы. Гигантская фигура Будды в храме Тодайдзи, созданная в VIII веке, весит более 400 тонн. Чтобы отлить такую статую, требовалось поистине выдающееся мастерство.
О меди
Среди товаров, которыми торговали в далекие времена александрийские купцы, большой популярностью пользовалась «медная зелень». С помощью этой краски модницы подводили зеленые круги под глазами — в те времена это считалось проявлением хорошего вкуса. С древних времен люди верили в чудодейственные свойства меди и использовали этот металл при лечении многих недугов.
Считалось, что медный браслет, одетый на руку, приносит своему владельцу удачу и здоровье, нормализует давление, препятствует отложению солей. Многие народы и в настоящее время приписывают меди целебные свойства. Жители Непала, например, считают медь священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько медных монет).
Один из самых больших и красивых храмов в Непале носит название «Медный». Был случай, когда медная руда стала виновником аварии, которую потерпело норвежское грузовое судно «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Внезапно прозвучал сигнал тревоги: судно дало течь.
Оказалось, что медь, содержащаяся в концентрате, образовала со стальным корпусом «Анатины» гальваническую пару, а испарения морской воды послужили электролитом. Возникший гальванический ток разъел обшивку судна до такой степени, что в ней появились дыры, куда и хлынула океанская вода.
Источник: http://polias.ru/index/0-9
Медь — Физические свойства
01 марта 2011
1. Медь
2. История и происхождение названия
3. Нахождение в природе4. Физические свойства
5. Применение
6. Биологическая роль
7. Производство, добыча и запасы меди
8. Интересные факты
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью. Имеет два стабильных изотопа — Cu и Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu и намного более стабильную Cu, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu2, полученных в 1994 году.
Карбонат меди имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди Существует два стабильных оксида меди — оксид меди Cu2O и оксид меди CuO.
Оксиды меди используются для получения оксида иттрия бария меди, который является основой для получения сверхпроводников. Хлорид меди — бесцветные кристаллы плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску.
Может быть синтезирован восстановлением хлорида меди сульфитом натрия в водном растворе.
Соединения меди
Многие соединения меди имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu → Cu + Cu
В то же время медь встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат-ион устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди:
CuCl + Cl →
Хлорид меди — белое нерастворимое твёрдое вещество. Как и другие галогениды меди, он имеет ковалентный характер и более устойчив, чем галогенид меди. Хлорид меди можно получить при сильном нагревании хлорида меди:
2CuCl2 → 2CuCl + Cl2
Ионы меди окрашивают пламя в зелёный цвет
Образует неустойчивый комплекс с CO
CuCl+CO → CuCl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат-ион.
При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди. Хлорид меди реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди.
Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Соединения меди и меди
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Источник: http://4108.ru/u/med_-_fizicheskie_svoystva
Физические и химические свойства меди, ее область применения
Медь в природе встречается в больших количествах и ее начали использовать еще в древние времена. Изучив свойства металла, из него начали делать полезные вещи для бытового употребления и охоты, а также украшения и другие нужные предметы.
Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара.
Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран. Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло.
Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Источник: https://vseprokamni.ru/metal/med-fizicheskie-svojstva.html
Подгруппа меди
| Температура плавления, °С |
Химический знак Сu, атомный вес 63,54. Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом: 3s23p63d104s1.
По внешнему виду медь — вещество красного цвета с характерным металлическим блеском. Медь — довольно мягкий металл, однако намного тверже, чем щелочные.
Следует отметить высокую пластичность меди, которую она проявляет не только в нагретом, но и в холодном состоянии.
Благодаря своей мягкости и пластичности медь может быть подвергнута холодной обработке. Отсюда широкое использование этого металла для изготовления художественных изделий при помощи чеканки. Не только сама медь, но и все металлы этой подгруппы обладают высокой пластичностью.
Медь что это такое
Один из лучших проводников тепла и электричества, однако для использования ее в этих целях медь обычно хорошо очищают от примесей других металлов, так как даже от незначительных загрязнений ее электропроводность сильно уменьшается.
Химические свойства меди и ее аналогов очень отличаются от свойств щелочных металлов, расположенных в главной подгруппе I группы. Так, они располагаются в ряду напряжений после водорода.
Степень окисления меди в окислительно-восстановительных реакциях +1 или +2. Других степеней окисления медь обычно не проявляет.
Медь довольно легко сплавляется с другими металлами, образуя ряд сплавов, наиболее распространенными из которых являются бронза (сплав, состоящий из меди и олова) и латунь (сплав меди и цинка).
При обычной температуре медь постепенно вступает во взаимодействие с кислородом, двуокисью углерода и влагой воздуха, превращаясь в основной карбонат меди. Этот процесс протекает очень медленно и объясняет причину, по которой изделия из меди с течением времени покрываются зеленым налетом.
При прокаливании на газовой горелке медь покрывается черным налетом окиси меди СuО. Нагретая медь довольно легко вступает во взаимодействие с хлором, образуя хлорид меди (II), и с некоторыми другими неметаллами.
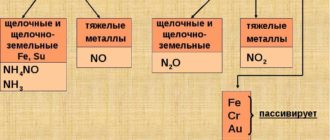
С разбавленными кислотами медь обычно в реакции не вступает, так как не может вытеснить водород, но с разбавленной азотной кислотой реагирует без вытеснения водорода, однако с выделением окиси азота.
С концентрированными серной и азотной кислотой медь также вступает в окислительно-восстановительную реакцию, которая также протекает без вытеснения водорода. Во всех названных реакциях медь в основном проявляет свою высшую валентность II. Соединения одновалентной меди получить значительно сложнее.
■ 8. Какова электронная конфигурация внешнего и предвнешнего слоя атома меди? (См. Ответ)
9. Перечислите физические свойства меди и укажите, где они находят себе применение.
10.
Напишите следующие уравнения реакций, характеризующих химические свойства меди: а) взаимодействие с кислородом; б) взаимодействие с хлором; в) взаимодействие с водой, кислородом и двуокисью углерода воздуха; г) с концентрированными серной и азотной кислотами; д) с разбавленной азотной кислотой.
Все уравнения рассмотрите с точки зрения окислительно-восстановительных процессов.
Если реакция ионная, запишите уравнение в полной и сокращенной ионной форме.
11. Для получения медного купороса CuSO4-5H2O медный лом прокаливают на воздухе и получившийся продукт обрабатывают 70% серной кислотой. Сколько меди и раствора серной кислоты израсходуется на получение 125 т медного купороса? Напишите уравнения протекающих при этом реакций.
12 Приведите все известные вам способы получения хлорида меди (II), сульфата меди (II), нитрата меди (II), исходя из чистой меди. Уравнения реакций записывайте в ионной форме, а в окислительно-восстановительных указывайте окислитель и восстановитель. Для реакций можно использовать дополнительно любые вещества. Процессы можно вести с любым количеством промежуточных веществ.
13. Почему металлическую медь можно получить электролизом раствора хлорида, а металлический натрий — нельзя. (См. Ответ)
Соединения меди
Медь образует два ряда соединений—соединения двухвалентной и одновалентной меди.
Соединения двухвалентной меди — это СuО (окись меди), гидроокись меди и наиболее распространенные соли.
Окись меди представляет собой твердое вещество черного цвета, поступает в лаборатории в виде порошка или гранул (гранулированная окись меди).
Ее получают обычно из металлической меди путем прокаливания на воздухе, а также разложением солей, например:
Cu2(OH)2CO3 = 2CuO + Н2O + CO2
Окись меди — основной окисел, при обычных условиях весьма устойчивый.
При небольшом нагревании окись меди довольно легко восстанавливается водородом или углеродом до металлической меди:
СuО + С = Сu + СО СuО + Н2 = Сu + Н2O
С водой окись меди никогда не реагирует, поэтому соответствующее ей основание — гидроокись меди Си(ОН)4— никогда не образуется путем взаимодействия окисла с водой.
Гидроокись меди — слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Сu(ОН)2 + H2SO4 = CuSO4 + 2Н2O
Cu(OH)2 + 2Н+ + SO2- = Cu2+ + SO24— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Взаимодействие со щелочами при некоторых условиях возможно, но совершенно нетипично, хотя и свидетельствует об очень слабо выраженных амфотерных свойствах. Гидроокись меди легко растворяется в аммиаке, образуя раствор ярко-синего цвета. Этот раствор нередко применяется в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы.
Гидроокись меди легко разлагается даже при простом хранении на воздухе:
Cu(OH)2 = СuО + Н20
При этом она чернеет, превращаясь постепенно в черную окись меди.
Из солей меди наиболее распространены медный купорос CuSO4 · 5H2O, хлорид меди СuСl2 · 2Н2O, нитрат меди Cu(NO3)2 · 3H2O, сульфид меди CuS. Кристаллогидраты медных солей при нагревании довольно легко отдают кристаллизационную воду, теряя свою окраску. Обычно кристаллические медные соли и их растворы имеют красивую голубую окраску.
Медные соли используют для борьбы с сельскохозяйственными вредителями, в текстильной промышленности для изготовления красителей.
В природе медь встречается в виде минерала — самородной меди, однако чаще ее добывают в виде сульфидов (важнейшие—халькозин Cu2S, халькопирит CuFeS2 ит.д).
Полученную из них медь очищают электролизом (рафинируют), а затем используют для изготовления проводов медных сплавов и других изделий.
■ 14. Как осуществить ряд превращений: (См. Ответ)
Сu → Cu(NO3)2 → CuO → Cu(OH)2 → CuSO4 → CuCl2.?
15. Окись меди прокалили в токе водорода, затем обработали концентрированной азотной кислотой до прекращения выделения бурого газа, далее, добавив щелочи, получили студенистый голубой осадок. Какие химические процессы происходили? Напишите их уравнения в молекулярной и ионных формах.
16. Даны окись меди, вода, серная кислота, нитрат серебра.
Как, не имея других веществ, получить медь, нитрат меди, сульфат меди.
17. Смесь карбоната и нитрата меди подвергли прокаливанию. Что останется в реакционном сосуде после прокаливания? Каков состав выходящей смеси газов?
18. Смесь меди с окисью меди обработали 30% азотной кислотой. При этом выделилось 2,8 л окиси азота. Известно, что в составе смеси медь составляет 40% Какой объем раствора азотной кислоты был израсходован на реакцию? (См.
Ответ)
Серебро и золото
Серебро Ag и золото Аu — аналоги меди, но относятся к числу так называемых благородных металлов. Такое название возникло из-за того, что эти металлы обладают значительной химической стойкостью к окислению.
Электронные конфигурации внешних и предвиешних слоев атомов серебра и золота:
Ag 3s23p63d104s24p64d105s1
Au 4s24p64d104f145s25p65d106s1.
Серебро и золото — наиболее ковкие металлы, причем на первом месте по мягкости и ковкости стоит золото, а серебро — на втором. Однако по электро- и теплопроводности на первом месте находится серебро. Цвет у этих металлов различный. Серебро белого цвета, а золото — желтого.
Как уже было сказано, серебро и золото устойчивы к окислению и длительное время могут сохраняться, не изменяя внешнего вида.
В связи с этим, а также благодаря мягкости они легко шлифуются, полируются и потому используются для разного рода поделок и украшений. Золото применяют в стоматологии для изготовления зубных коронок. Серебро также используют в медицине для изготовления некоторых инструментов.
Гораздо чаще, чем чистые металлы, применяют их сплавы с медью, обладающие антикоррозийной стойкостью, но благодаря меди — большей твердостью и лучшими механическими свойствами.
Несмотря на сравнительную химическую устойчивость, серебро и золото могут подвергаться воздействию некоторых реактивов. Серебро, например, может реагировать с азотной кислотой, как с разбавленной, так и с концентрированной:
Ag + HNО3 → (Ag+1; N+4) (конц.)
Ag + HNО3 → (Ag+1; N+2) (разб.)
а также с концентрированной серной кислотой:
Ag + H2SО4 → (Ag+1 S+4)
• Продукты реакции определите сами и найдите коэффициенты на основе электронного баланса.
Золото не реагирует с азотной кислотой. Отсутствие реакции при испытании золотого предмета азотной кислотой является подтверждением его состава. Однако смесь концентрированных азотной и соляной кислот под названием «царская водка» окисляет золото (см. § 72).
Ионы серебра Ag+1, попадая в раствор даже в ничтожно малых количествах, оказывают бактерицидное действие. Именно поэтому, например, очень долгое время может сохраняться так называемая «святая вода», которую священнослужители держат в серебряной посуде.
Из окислов следует отметить окись серебра Ag2О — вещество черного цвета, растворимое в аммиаке и проявляющее окислительные свойства особенно по отношению к некоторым органическим веществам.
Галогениды серебра, кроме фторида, в воде нерастворимы и несколько различаются между собой по цвету: хлорид — белый, бромид — желтоватый, иодид — желтый. Хлорид легко растворим в аммиаке.
Бромид серебра особенно чувствителен к свету, как уже говорилось в § 42. Нитрат серебра AgNО3 широко применяется в химических лабораториях, а также в медицине в виде так называемого ляписа.
Соединения золота не имеют особого практического значения, поэтому мы на них останавливаться не будем.
В природе золото встречается в основном в самородном состоянии в виде песка, самородков. Серебро чаще всего встречается в виде сульфида Ag2S, получившего название «серебряный блеск». Соединения серебра часто сопутствуют другим металлам — меди, свинцу, сурьме и др.
■ 19. Почему при лечении зубов применяют в основном серебро и золото? (См. Ответ)
20. Почему серебро и золото причисляют к благородным металлам? Перечислите возможно более полно физические свойства этих металлов
21. Объясните процесс растворения золота в «царской водке» и напишите уравнения реакций.
22. Перечислите области применения серебра и золота. (См. Ответ)
Статья на тему Подгруппа меди
Источник: https://znaesh-kak.com/x/s/%D0%BF%D0%BE%D0%B4%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0-%D0%BC%D0%B5%D0%B4%D0%B8