Все о крещенской воде: когда набирать, как правильно пить и что нельзя делать
Воду, которую освятили в праздник Крещение Господне, называют «великой агиасмой». Она считается святыней. Верующие бережно хранят ее и понемногу пьют в течение года. Главное, что нужно знать о крещенской воде — в материале altapress.ru.
19 декабря 2019 года в Барнауле. Крещение.
Анна Зайкова.
Воду, освященную на Крещение Господне, называют «крещенской» или «богоявленской». В православных храмах воду освящают в Сочельник и на Крещение, то есть 18 и 19 января.
«Великую агиасму» бережно хранят и понемногу пьют в течение года. Считается, что она обладает особыми свойствами: долго не портится и помогает избавить от недугов. Однако в церкви предостерегают, что крещенскую воду не стоит воспринимать как лекарство.
Крещенскую воду нужно пить с молитвой и благоговением. Еще крещенской водой можно окропить квартиру. При этом обычно поют специальную молитву — тропарь Крещения Господня.
19 декабря 2019 года в Барнауле. Крещение.
Анна Зайкова.
Как правильно пить крещенскую воду
Святую воду на Крещение и в Сочельник можно пить весь день. А в обычные дни ее традиционно пьют понемногу: утром, натощак и с молитвой.
Но натощак — это не обязательное условие. Главное — принимать святую воду с благоговением и молитвой. Также крещенскую воду можно разбавить, и она не потеряет своих свойств.
Правда ли, что купание в проруби на Крещение смывает грехи
Нет, по церковным канонам купание в ледяной купели не очищает человека от грехов. И на это не влияет, сколько раз человек нырнул или перекрестился.
Купание в проруби на Крещение — народных обычай, а не церковный обряд. Согласно православному учению, душу от грехов очищает только искреннее покаяние в таинстве исповеди.
Крещение в Барнауле 19 января 2019 года.
Анна Зайкова.
Что нельзя делать с крещенской водой
Святой водой нельзя мыть пол, мыться в бане, добавлять в чай давать пить домашним животным и прочее.
Кроме того, святой водой нельзя смыть порчу и сглаз, потому что с точки зрения церкви сглаза и порчи не существует.
Важно знать, что православная церковь отрицательно относится к оккультным и магическим практикам, гаданиям, приворотам и другим подобным практикам.
Источник: https://altapress.ru/zhizn/story/vse-o-kreshchenskoy-vode-kogda-nabirat-kak-pravilno-pit-i-chto-nelzya-delat-260836
Хим. свойства простых веществ
Все химические элементы разделяют наметаллыинеметаллыв зависимости от строения и свойств их атомов. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
В Периодической системе химических элементов Д.И. Менделеева неметаллы расположены по диагонали: бор – астат и над ней в главных подгруппах.
Для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4; сурьма и висмут — 5; полоний — 6 электронов).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов – три).
Отсюда стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
Металлы
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют с неметаллами:
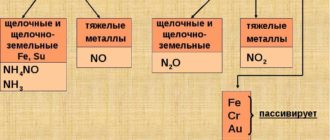
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия — надпероксид
2Na + O2 = Na2O2, К + О2 = КО2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
2Na + Na2O2 = 2Na2O
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
Ca + H2 = CaH2
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2 = 2K3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2
Ba + H2O = Ba(OH) 2 + H2
Магний взаимодействует с водой при кипячении.
Mg + 2H2O = Mg(OH) 2 + H2
Алюминий при удалении оксидной пленки бурно реагирует с водой.
2Al + 6H2O = 2Al(OH) 3 + 3H2
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов.
3Fe + 4H2O = Fe3O4 + 4H2
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2
Обратите внимание: образуются соли двухвалентного железа.
Fe + H2SO4(разб.) = FeSO4 + H2
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH) 4] + H2
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
2C2H5OH + 2Na = 2C2H5ONa + H2
2C6H5OH + 2Na = 2C6H5ONa + H2
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А.Вюрца):
CH2Cl-CH2-CH2Cl + Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
Неметаллы
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2, Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
Строение простых веществ – неметаллов:
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2, Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Gen, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
Химические свойства неметаллов
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
Источник: https://school4eg.jimdofree.com/%D1%85%D0%B8%D0%BC-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BF%D1%80%D0%BE%D1%81%D1%82%D1%8B%D1%85-%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2/
Почему биткоин не свергнут с трона короля крипторынка — 20.01.2020
- Это все о ходлинге
- Ethereum упустил свой шанс
Несмотря на то, что рынок альткоинов существуют более 10 лет, единственная криптовалюта, которая иногда упоминается в качестве главного конкурента биткоина – это Ethereum.
Еще в 2016 году было много ажиотажа вокруг того, что ЕТН вскоре обгонит ВТС и может занять место самого популярного и крупнейшего криптоактива.
Однако с тех пор цена на Ethereum довольно сильно упала, а биткоин по-прежнему не теряет своих доминирующих позиций.
Есть несколько причин полагать, что биткоин останется королем крипторынка. Этому способствуют технические инновации и растущий сетевой эффект. В целом за последние пару лет большей части монет так и не удалось приблизиться к показателям ВТС. В 2019 году более успешными, чем первая криптовалюта, оказались только два основных альткоина.
Своим мнением о перспективах биткоина как главного актива-убежища поделились основатель венчурного криптофонда Dragonfly Capital Алекс Пак и управляющий партнер компании Хасиб Куреши.
Это все о ходлинге
В первую очередь Куреши отметил, что Lightning Network сегодня не пользуется особым спросом. Протокол биткоина второго уровня был создан, чтобы предоставить пользователям возможность выполнять более быстрые и дешевые платежи при сохранении приемлемого уровня децентрализации.
Хотя проект активно раскручивался в течение нескольких лет, биткоин-платежи на основе LN так и не получили широкого распространения, а производительность сети все еще находится на низком уровне.
«Очевидно, что основной причиной покупки биткоина людьми является накапливание и хранение криптовалюты в расчете на серьезные прибыли в долгосрочной перспективе, а не совершение сделок с использованием небольших сумм», — сказал Куреши.
Именно дискуссии относительно медленного темпа принятия Lightning Network привели к тому, что многие начали рассматривать полезность биткоина на более глобальном уровне в качестве перспективного средства сбережения.
«Запуск боковых цепей, как LN или сеть смарт-контрактов RSK – незначительные дополнения к сети биткоина. Реальность рынка такова, что люди хотят покупать и держать ВТС потому, что видят в нем эффективный актив-убежище, цифровой накопитель стоимости. Если Lightning Network не сработает, в будущем биткоин будет использоваться именно для этой цели», — добавил Куреши.
Он также полагает, что не стоит ожидать больших изменений в сети биткоина, хотя будут развиваться дополнительные уровни, такие как Liquid sidechain, и внедрятся незначительные улучшения для повышения конфиденциальности и производительности.
«Я думаю, что идея о том, что биткоин станет средством обмена, всегда была чем-то вроде либертарианской несбыточной мечты», — поддержал мнение Куреши основатель Dragonfly Capital Алекс Пак.
Ethereum упустил свой шанс
По словам Хасиба, когда он впервые попал в криптопространство, дополнительные возможности разработки в блокчейне Ethereum казались очень привлекательными. Он считал биткоин устаревшей технологией, которая мало на что способна. Куреши был уверен, что в какой-то момент ЕТН превзойдет первую криптовалюту и станет наиболее широко используемым, ценным и стабильным активом.
«В то время я просто не понимал, что биткоин – это намного больше, чем просто криптопроект с открытым исходным кодом», — сказал Хасиб.
Он также отметил, что его вера в процветающее будущее Ethereum и способность доминировать на рынке сохранялась в течение всего периода пузыря ICO, во время пика шумихи вокруг ЕТН. Однако позже стало более очевидным ценностное предложение биткоина.
«Тот факт, что биткоин на протяжении многих лет остается стабильным и не меняется, делает его таким ценным. Ethereum, в свою очередь, пытается быть другим и не стремится стать цифровым золотом. В то же время биткоин со своей ограниченной эмиссией, дефляционными характеристиками и свойством накопления ценности вполне может конкурировать с драгоценным металлом», — подчеркнул Куреши.
По словам Хасиба, в 2019 году биткоин сделал значительный рывок вперед, несмотря на волатильность. Более того, многие лидеры отрасли прогнозируют резкое повышение стоимости ВТС до уровня $20 000- $50 000 в этом году. Дополнительным стимулом для продвижения ведущей криптовалюты и перехода рынка на новый уровень может стать запуск биткоин-ETF, который должен произойти в 2020 году.
«Ethereum упустил свой шанс опередить биткоин. В данный момент уже довольно сложно какой-либо криптовалюте свергнуть его с пьедестала короля крипторынка, который уверенно движется к тому, чтобы стать цифровым золотом и главным хранилищем стоимости», — уверен Куреши.
Переведено редакцией LetKnow.News
оценка материала:
Источник: https://letknow.news/publications/pochemu-bitkoin-ne-svergnut-s-trona-korolya-kriptorynka-35676.html