Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
В природе алюминий встречается в виде минералов:
- Al2O3 — корунд
- 3BeO*Al2O3*6SiO2 — берилл (аквамарин — примесь Fe и изумруд — примесь Cr2O3)
- Al2O3*Cr2O3 — красный рубин
- Al2O3 с примесью Fe+2/Fe+3/Ti
- Al2O3*H2O — боксит
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3AlF6). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Al2O3 → (t) Al + O2 (в расплаве криолита — Na3AlF6)
- Реакции с неметаллами
- Реакции с кислотами и щелочами
- Реакция с водой
- Алюминотермия
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой — Al2O3)Al + Br2 → AlBr3 (бромид алюминия)При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.Al + F2 → (t) AlF3 (фторид алюминия)Al + S → (t) Al2S3 (сульфид алюминия)Al + N2 → (t) AlN (нитрид алюминия)Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.Al + HCl → AlCl3 + H2Al + H2SO4(разб.) → Al2(SO4)3 + H2Al + H2SO4(конц.) → Al2(SO4)3 + SO2 + H2OAl + HNO3(разб.) → Al(NO3)3 + N 2O + H2OAl + NaOH + H2O → Na[Al(OH)4] + H2 (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)При прокаливании комплексные соли не образуются, так вода испаряется:Na[Al(OH)4] → NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.Al + H2O → Al(OH)3 + H2
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.Fe2O3 + Al → Al2O3 + FeCr2O3 + Al → Al2O3 + CrMnO2 + Al → Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.Al + O2 → Al2O3Al(OH)3 → (t) Al2O3 + H2OПроявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.Al2O3 + H2SO4 → Al2(SO4)3 + H2OAl2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.AlBr3 + LiOH → Al(OH)3↓ + LiBrAl(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 — по аниону)Al2S3 + H2O → Al(OH)3↓ + H2SПроявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.Al(OH)3 + H2SO4 → Al2(SO4)3 + H2OAl(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
Источник: https://studarium.ru/article/165
История появления алюминия и первые практики применения
Применяемый практически во всех сферах жизни общества металл имеет относительно недолгую историю развития: впервые в 16 веке к решению проблемы его получения приступил Парацельс.
Применяемый практически во всех сферах жизни общества металл имеет относительно недолгую историю развития: впервые в 16 веке к решению проблемы его получения приступил Парацельс. Именно он назвал окись алюминия «вяжущей», то есть «alumen».
Дело Парацельса в 18 веке продолжил Андреас Маргграф, он поднял в науке вопрос о возможных свойствах алюминия, но в чистом виде выделить не смог.
Как появился первый слиток?
Хэмфри Дэви, английский ученый, в 1808 году попытался получить чистый алюминий с помощью электролиза, он же дал веществу его современное наименование. К 1825 году в Дании Ханс-Кристиан Эрстед сумел выделить хлористый алюминий, далее он получил металл, свойства которого были весьма схожи с характеристиками олова.
Первый слиток стал результатом 18-летнего труда немецкого ученого Фридриха Велера. Все последующие годы предпринимались попытки открыть дешёвые способы получения чистого алюминия.
Так как металл был приравнен по цене к традиционным драгоценным, французские промышленники поставляли его к императорскому двору для производства предметов роскоши и ювелирных украшений.
К концу 19 века американский студент и французский инженер параллельно сумели добиться дешёвого метода производства алюминия за счёт электролиза. Так как требовались большие объёмы электроэнергии, первые заводы стали строить неподалёку от водопадов.
Австралийский инженер Байер внёс значимую лепту в историю развития алюминиевой промышленности: он научился получать глинозём по экономичной технологии, которая используется и сегодня. Альфред Вильм усилил прочность алюминия, выплавив его с небольшим добавлением магния, меди и марганца.
К 20-му веку ежегодные объёмы производства алюминия достигли 8 тыс. тонн.
Современность: влияние алюминиевой промышленности на все сферы производства
Рассматриваемый металл является незаменимым компонентом в архитектуре, рекламном производстве, пищевой промышленности, строительстве, дизайне, медицине и пр., в частности, широкий алюминиевый пруток в продаже (http://www.alfa-sous.ru/4/czvetnoj-metalloprokat/14/krug-alyuminievyij.html)занимает лидирующие позиции по востребованности. Если рассматривать общую распространённость вещества, в промышленности больше алюминия используется лишь железо.
Достижения первооткрывателей металла получили спрос благодаря уникальным свойствам алюминия – он очень пластичный, обладает показательными параметрами ковкости. Благодаря оксидной плёнке он не боится коррозии, за счёт чего эксплуатационный срок становится однозначно долгим. Положительными свойствами являются также нетоксичность, усиленная электропроводимость, простота переработки. Благодаря появлению алюминия получили развитие самолёты и космическая индустрия.
Металл все ещё остаётся достаточно дорогим, поэтому большое значение для мировой промышленности имеет организация вторичной переработки алюминия. По всей стране в пункты приёма цветного лома население постоянно приносит вышедшие из употребления предметы домашнего обихода, посуду, проволоку, так как вознаграждение, исчисляемое за каждый килограмм, достойно внимания и трудов.
Источник: http://www.technoflax.com/istoriya-poyavleniya-alyuminiya-i-primenenie.html
История алюминия. Описание
Алюминий – самый известный и древний металл. В виде различных глинистых соединений он был знаком человечеству с незапамятных времен. Античные историки свидетельствовали о том, что “люмен” ( в переводе с латинского квасцы) или сульфат алюминия-калия применяли в самых разных областях деятельности: и как протраву для окрашивания тканей, и как огнезащитное средство, а также использовали для изготовления различных бытовых изделий и украшений.
История получения и применения алюминия
В середине XIX века в Западной Европе ученые отчаянно пытались получить алюминий в чистом виде. В 1825 году датский исследователь Х.К. Эрстед первым осуществил подобный опыт, используя калий в виде амальгамы. К сожалению, тогда не удалось точно определить полученное вещество.
Однако спустя два года получением алюминия заинтересовался немецкий ученый Велер. Он использовал для восстановления металла чистый калий. Через 20 лет упорных поисков ему удалось получить чистый алюминий в виде гранул размером со спичечную головку. Алюминий оказался красивым и легким металлом, похожим на серебро. Эти свойства алюминия и определили его высокую стоимость на тот период истории: он оценивался дороже золота.
В 1855 г. на выставке в Париже алюминий являлся главной достопримечательностью. Ювелирные изделия из алюминия располагались по соседству с бриллиантами французской короны. Алюминий стал очень модным металлом. Его считали благородным элементом, созданным природой для создания шедевров искусства.
Поскольку физические и химические свойства алюминия были изучены слабо, ювелиры самостоятельно изобретали способы его обработки. Мягкость и податливость металла позволяла создавать им изделия любой формы, делать отпечатки замысловатых узоров, наносить разнообразные рисунки. Алюминий покрывали золотом, полировали, матировали.
Однако со временем алюминий стал выходить из моды. В середине 1860-х годов килограмм этого металла уже стоил всего около ста старых франков, по сравнению с 3 тысячами в 1854-1856 гг.
В настоящее время первые алюминиевые изделия представляют огромную ценность. К сожалению, большую часть из них почитатели моды заменили золотом, серебром и другими драгоценными сплавами и металлами.
Однако ученых изменчивая мода не остановила. В 1886 году химик Чарльз Мартин Холл стал автором дешевого способа получения алюминия в больших количествах. Он добавил и растворил в расплавленном криолите (соединении алюминия с натрием и фтором) небольшую часть окиси алюминия. Затем, поместив смесь в гранитный сосуд, пропустил через нее электрический ток.
После нескольких часов ожидания на дне сосуда он увидел блестящие «пуговицы» чистого алюминия. Работавший в то время в России австрийский инженер Карл Жозеф Байер не остался в стороне и предложил технологию получения глинозема, которая помогла сделать новый способ еще дешевле.
В результате вариант получения алюминия, разработанный Байером и Холлом, до сих пор используется в современном производстве.
Совершенствование свойств алюминия
Новый материал, который теперь можно было применять в промышленности, был всем хорош. Однако отмечалось, что чистый алюминий недостаточно прочен для некоторых областей применения.
В борьбу с этой проблемой вступил немецкий химик Альфред Вильм, который сплавил его с небольшим количеством магния, меди и марганца. Полученный сплав был настолько прочен, что в 1911 году в городке Дюрене была выпущена партия материала, названного в его честь дюралюминием. Чуть позже в 1919 году из него был выполнен первый самолет. Так алюминий с триумфом завоевал весь мир.
В настоящее время трудно назвать отрасль промышленности, обходящуюся без этого легкого серебристого металла.
Алюминий, занимающий 3 место по концентрации в земной коре после кислорода и кремния, с новой силой притягивает к себе внимание специалистов как металл будущего.
Совокупность таких его достоинств, как малая плотность, высокая тепло- и электропроводность, прочностные характеристики, а также высокая устойчивость к коррозии и технологичность, позволяют отнести алюминий к числу самых ценных материалов планеты.
Источник: https://oxi-pro.ru/istoriya-polucheniya-i-primeneniya-alyuminiya
Алюминий: свойства химические и физические
Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.
История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла — алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.
Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл — один из самых популярных и применяемых в строительстве и бытовой промышленности.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер — 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса — 26,98.
- Количество валентных электронов — 3.
- Конфигурация внешнего слоя выражается формулой 3s23p1.
- Название элемента — алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ — AL, в формулах читается как «алюминий».
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.
Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления — 660 0С.
- Температура кипения — 2450 0С.
- Плотность — 2,7 г/см3.
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи — металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл — сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное — это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
- кислотами;
- щелочами;
- галогенами;
- серой.
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.
Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами — AL + HCL = AlCL3 + H2;
- щелочами — 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами — AL + Hal = ALHal3;
- серой — 2AL + 3S = AL2S3.
В целом, самое главное свойство рассматриваемого вещества — это высокая способность к восстановлению других элементов из их соединений.
Восстановительная способность
Восстановительные свойства алюминия хорошо прослеживаются на реакциях взаимодействия с оксидами других металлов. Он легко извлекает их из состава вещества и позволяет существовать в простом виде. Например: Cr2O3 + AL = AL2O3 + Cr.
В металлургии существует целая методика получения веществ, основанная на подобных реакциях. Она получила название алюминотермии. Поэтому в химической отрасли данный элемент используется именно для получения других металлов.
Распространение в природе
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.
Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.
Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие — это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.
Вместе с железом и его сплавами алюминий — самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид — самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, — он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия — это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] — тетрагидроксоалюминат натрия.
Источник: https://FB.ru/article/190101/alyuminiy-svoystva-himicheskie-i-fizicheskie
№13 Алюминий
Около 1807 г. Дэви, пытавшийся осуществить электролиз глинозема, дал название предполагаемому в нем металлу алюмиум (Alumium). Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. В 1827 г. Велер выделил металлический алюминий более эффективным способом — нагреванием безводного хлористого алюминия с металлическим калием.
Нахождение в природе, получение:
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. алюминия в земной коре по данным различных исследователей составляет от 7,45% до 8,14% от массы земной коры. В природе алюминий встречается только в соединениях (минералах).
Корунд: Al2O3 — относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях.
Бокситы: Al2O3*nH2O — осадочные алюминиевые руды. Содержат вредную примесь — SiO2. Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов.
Каолинит: Al2O3*2SiO2*2H2O — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF3 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке. Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии.
Физические свойства:
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см3, температура плавления 660°C, температура кипения 2500°C. Высокая пластичность, прокатывается в тонкий лист и даже фольгу. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. Алюминий образует сплавы почти со всеми металлами.
Химические свойства:
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Однако, при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами: кислородом, галогенами: 2Al + 3Br2 = 2AlBr3С другими неметаллами алюминий реагирует при нагревании:
2Al + 3S = Al2S3 2Al + N2 = 2AlN
Алюминий способен только растворять водород, но не вступает с ним в реакцию.Со сложными веществами: алюминий реагирует со щелочами (с образованием тетрагидроксоалюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Легко растворяется в разбавленной и концентрированной серной кислотах:
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Алюминий восстанавливает металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Важнейшие соединения:
Оксид алюминия, Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный — более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О Al2O3 + 2NаОН(конц.) + 3Н2О = 2Na[Al(OH)4]
(в расплаве щелочи образуется NaAlO2).
Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства.При сплавлении с NaOH образуется NaAlO2.
Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака — при комнатной температуре образуется Аl(ОН)3
Соли алюминия.
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк:Al3+ + H2O =AlOH2+ + H+
Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия — квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов).
Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным.
Бинарные соединения алюминия Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Применение:
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость, высокая теплопроводность. Алюминий является важным компонентом многих сплавов (медные — алюминиевые бронзы, магниевые и др.) Применяется в электротехнике для изготовления проводов, их экранирования.
Алюминий широко используется и в тепловом оборудовании и в криогенной технике.Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал.Алюминий и его соединения используются в ракетной технике в качестве ракетного горючего.
В производстве строительных материалов как газообразующий агент.
Аллаяров Дамир
ХФ ТюмГУ, 561 группа.
Источник: http://www.kontren.narod.ru/x_el/info13.htm
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города.
В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла.
Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции.
Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью.
Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру.
Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов.
Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель.
В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит.
С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Рассмотрим, как используют различные изделия из алюминия
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминиевый лист
Алюминиевая плита
Алюминиевые чушки
Алюминиевые уголки
Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Источник: https://cu-prum.ru/alyuminij1.html
Свойства алюминия и области применения в промышленности и быту (стр. 1 из 4)
Федеральное агентство по образованию РФ
Государственный технологический университет
«Московский институт стали и сплавов»
Российская олимпиада школьников
«Инновационные технологии и материаловедение»
II-й этап: Научно-творческий конкурс
Направление (профиль):
«Материаловедение и технологии новых материалов»
РЕФЕРАТ
на тему:
«Свойства алюминия и области применения в промышленности и быту«
Работу выполнил:
Зайцев Виктор Владиславович
Москва, 2009
1. Введение
1.1 Общее определение алюминия
1.2 История получения алюминия
2. Классификация алюминия по степени чистоты и его механические свойства
3. Основные легирующие элементы в алюминиевых сплавах и их функции
4. Применение алюминия и его сплавов в промышленности и быту
4.1 Авиация
4.2 Судостроение
4.3 Железнодорожный транспорт
4.4 Автомобильный транспорт
4.5 Строительство
4.6 Нефтяная и химическая промышленность
4.7 Алюминевая посуда
5. Заключение
5.1. Алюминий — материал будущего
6. Список используемой литературы
1. Введение
В своём реферате на тему ”Свойства алюминия и области применения в промышленности и быту” я хотел бы указать на особенность этого металла и его превосходство перед другими. Весь мой текст является доказательством того, что алюминий метал будущего и без него будет трудным наше дальнейшее развитие.
1.1 Общее определение алюминия
Алюминий (лат. Aluminium, от alumen — квасцы) — химический элемент III гр. периодической системы, атомный номер 13, атомная масса 26,98154. Серебристо-белый металл, легкий, пластичный, с высокой электропроводностью, tпл = 660 °С. Химически активен (на воздухе покрывается защитной оксидной пленкой).
По распространенности в природе занимает 3-е место среди элементов и 1-е среди металлов (8,8% от массы земной коры). По электропроводности алюминий — на 4-м месте, уступая лишь серебру (оно на первом месте), меди и золоту, что при дешевизне алюминия имеет огромное практическое значение.
Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых. Его плотность равна всего 2,7*103кг/м3. Алюминий имеет решётку гранецентрированного куба, устойчив при температурах от — 269 °С до точки плавления (660 °С). Теплопроводность составляет при 24°С 2,37 Вт×см-1×К-1.
Электросопротивление алюминия высокой чистоты (99,99%) при 20°С составляет 2,6548×10-8 Ом×м, или 65% электросопротивления международного эталона из отожжённой меди. Отражательная способность полированной поверхности составляет более 90%.
1.2 История получения алюминия
Документально зафиксированное открытие алюминия произошло в 1825. Впервые этот металл получил датский физик Ганс Христиан Эрстед, когда выделил его при действии амальгамы калия на безводный хлорид алюминия (полученный при пропускании хлора через раскаленную смесь оксида алюминия с углем). Отогнав ртуть, Эрстед получил алюминий, правда, загрязненный примесями. В 1827 немецкий химик Фридрих Вёлер получил алюминий в виде порошка восстановлением гексафторалюмината калием.
Современный способ получения алюминия был открыт в 1886 молодым американским исследователем Чарльзом Мартином Холлом. (С 1855 до 1890 было получено лишь 200 тонн алюминия, а за следующее десятилетие по методу Холла во всем мире получили уже 28000т. этого металла) Алюминий чистотой свыше 99,99% впервые был получен электролизом в 1920г. В 1925 г. в работе Эдвардса опубликованы некоторые сведения о физических и механических свойствах такого алюминия. В 1938г.
Тэйлор, Уиллей, Смит и Эдвардс опубликовали статью, в которой приведены некоторые свойства алюминия чистотой 99,996%, полученного во Франции также электролизом. Первое издание монографии о свойствах алюминия вышло в свет в 1967г. Еще недавно считалось, что алюминий как весьма активный металл не может встречаться в природе в свободном состоянии, однако в 1978г.
в породах Сибирской платформы был обнаружен самородный алюминий — в виде нитевидных кристаллов длиной всего 0,5 мм (при толщине нитей несколько микрометров). В лунном грунте, доставленном на Землю из районов морей Кризисов и Изобилия, также удалось обнаружить самородный алюминий. Предполагают, что металлический алюминий может образоваться конденсацией из газа.
При сильном повышении температуры галогениды алюминия разлагаются, переходя в состояние с низшей валентностью металла, например, AlCl. Когда при понижении температуры и отсутствии кислорода такое соединение конденсируется, в твердой фазе происходит реакция диспропорционирования: часть атомов алюминия окисляется и переходит в привычное трехвалентное состояние, а часть — восстанавливается. Восстановиться же одновалентный алюминий может только до металла: 3AlCl > 2Al + AlCl3.
В пользу этого предположения говорит и нитевидная форма кристаллов самородного алюминия. Обычно кристаллы такого строения образуются вследствие быстрого роста из газовой фазы. Вероятно, микроскопические самородки алюминия в лунном грунте образовались аналогичным способом.
2. Классификация алюминия по степени чистоты и его механические свойства
В последующие годы благодаря сравнительной простоте получения и привлекательным свойствам опубликовано много работ о свойствах алюминия. Чистый алюминий нашёл широкое применение в основном в электронике — от электролитических конденсаторов до вершины электронной инженерии — микропроцессоров; в криоэлектронике, криомагнетике.
Более новыми способами получения чистого алюминия являются метод зонной очистки, кристаллизация из амальгам (сплавов алюминия со ртутью) и выделение из щёлочных растворов. Степень чистоты алюминия контролируется величиной электросопротивления при низких температурах.
В настоящее время используется следующая классификация алюминия по степени чистоты:
Механические свойства алюминия при комнатной температуре:
Чистый алюминий — довольно мягкий металл — почти втрое мягче меди, поэтому даже сравнительно толстые алюминиевые пластинки и стержни легко согнуть, но когда алюминий образует сплавы (их известно огромное множество), его твердость может возрасти в десятки раз. Наиболее широко применяются:
Бериллий добавляется для уменьшения окисления при повышенных температурах. Небольшие добавки бериллия (0,01 — 0,05%) применяют в алюминиевых литейных сплавах для улучшения текучести в производстве деталей двигателей внутреннего сгорания (поршней и головок цилиндров).
Бор вводят для повышения электропроводимости и как рафинирующую добавку. Бор вводится в алюминиевые сплавы, используемые в атомной энергетике (кроме деталей реакторов), т.к он поглощает нейтроны, препятствуя распространению радиации. Бор вводится в среднем в количестве 0,095 — 0,1%.
Висмут. Металлы с низкой температурой плавления, такие как висмут, свинец, олово, кадмий вводят в алюминиевые сплавы для улучшения обрабатываемости резанием. Эти элементы образуют мягкие легкоплавкие фазы, которые способствуют ломкости стружки и смазыванию резца.
Галлий добавляется в количестве 0,01 — 0,1% в сплавы, из которых далее изготавливаются расходуемые аноды.
Железо. В малых количествах (»0,04%) вводится при производстве проводов для увеличения прочности и улучшает характеристики ползучести. Так же железо уменьшает прилипание к стенкам форм при литье в кокиль.
Индий. Добавка 0,05 — 0,2% упрочняют сплавы алюминия при старении, особенно при низком содержании меди. Индиевые добавки используются в алюминиево-кадмиевых подшипниковых сплавах.
Примерно 0,3% кадмия вводят для повышения прочности и улучшения коррозионных свойств сплавов.
Кальций придаёт пластичность. При содержании кальция 5% сплав обладает эффектом сверхпластичности.
Кремний является наиболее используемой добавкой в литейных сплавах. В количестве 0,5 — 4% уменьшает склонность к трещинообразованию. Сочетание кремния с магнием делают возможным термоуплотнение сплава.
Магний. Добавка магния значительно повышает прочность без снижения пластичности, повышает свариваемость и увеличивает коррозионную стойкость сплава.
Медь упрочняет сплавы, максимальное упрочнение достигается при содержании меди 4 — 6%. Сплавы с медью используются в производстве поршней двигателей внутреннего сгорания, высококачественных литых деталей летательных аппаратов.
Олово улучшает обработку резанием.
Титан. Основная задача титана в сплавах — измельчение зерна в отливках и слитках, что очень повышает прочность и равномерность свойств во всём объёме.
Алюминий — один из самых распространенных и дешевых металлов. Без него трудно представить себе современную жизнь. Недаром алюминий называют металлом 20 века. Он хорошо поддается обработке: ковке, штамповке, прокату, волочению, прессованию.
Чистый алюминий — довольно мягкий металл; из него делают электрические провода, детали конструкций, фольгу для пищевых продуктов, кухонную утварь и «серебряную» краску. Этот красивый и легкий металл широко используют в строительстве и авиационной технике. Алюминий очень хорошо отражает свет.
Поэтому его используют для изготовления зеркал — методом напыления металла в вакууме.
Источник: https://mirznanii.com/a/325500/svoystva-alyuminiya-i-oblasti-primeneniya-v-promyshlennosti-i-bytu
Алюминий: характеристика, свойства, получение. Конспект по химии — УчительPRO
Ключевые слова конспекта: алюминий, свойства алюминия, получение и применение алюминия, алюмосиликаты, глина, оксид алюминия, боксит, дюралюмин, дюраль.
Алюминий Al – элемент № 13, 3–го периода, IIIA группы, Ar (Al) = 27. Электронная конфигурация невозбуждённого атома алюминия 1s22s22p6 3s23p1:
Алюминий является р-элементом. В своих соединениях он всегда имеет степень окисления +3. Оксид и гидроксид алюминия (Al2O3 и Al(ОН)3 соответственно) амфотерны. Существует водородное соединение алюминия – гидрид алюминия AlH3 (алан) – белый порошок.
По распространённости в земной коре алюминий занимает 4-е место (после О, Si, Н). Основная масса алюминия сосредоточена в алюмосиликатах. Продуктом разрушения алюмосиликатов является глина, она состоит из каолинита – Al2O3 • 2SiO2 • 2H2O. Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Из других минералов наибольшее распространение имеет боксит – Al2O3 • nH2O.
АЛЮМИНИЙ – ПРОСТОЕ ВЕЩЕСТВО
Алюминий – серебристо-белый металл (на воздухе покрывается плотной тонкой плёнкой оксида), плотность 2,7 г/см3 (лёгкий металл), легкоплавкий (t°пл. = 660 °С).
На воздухе алюминий покрывается прочной тончайшей (10–8 м) защитной плёнкой оксида, которая препятствует проникновению кислорода к металлу и практически полностью прекращает дальнейшее окисление.
Алюминиевый порошок сгорает при нагревании в кислороде:
При окислении алюминия выделяется большое количество теплоты. Нагретый порошок алюминия при попадании в атмосферу кислорода реагирует с выделением огромного количества теплоты, достигается температура до 3000–3500 °С. Тепловой эффект реакции алюминия с кислородом чрезвычайно высок, образование этого соединения энергетически очень выгодно.
При нагревании алюминий легко реагирует с серой:
Алюминиевый порошок легко реагирует с галогенами и сгорает в атмосфере хлора. Кусочек алюминия, с которого снята оксидная плёнка, бурно реагирует с бромом. Эти реакции идут без нагревания:
Алюминиевый порошок реагирует с кристаллическим йодом, в присутствии катализатора (или при нагревании) выделяются капельки воды.
Алюминий без оксидной плёнки реагирует с азотом при сильном нагревании (800–1200 °С), образуя нитрид алюминия:
При сильном нагревании (1500–1700 °С) алюминий реагирует с углеродом (графитом) с образованием карбида алюминия:
Алюминий непосредственно не реагирует с водородом. Гидрид алюминия получают косвенным путём.
Алюминий энергично взаимодействует с водой, если механическим путём или амальгамированием снять предохраняющее действие оксидной плёнки:
Вследствие высокого теплового эффекта соединения алюминия с кислородом алюминий активно восстанавливает многие металлы из оксидов (алюмотермия):
При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200–3000 °С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов.
Как метод получения металлов, алюмотермия была предложена Н. Бекетовым в 1859 г. Её используют для получения многих металлов (Мп, Cr, V, W, Sr, Ва и др.).
Алюминий реагирует с галогеноводородными кислотами, разбавленной серной и азотной кислотами с образованием солей, в которых алюминий находится в катионной форме, и выделением водорода. Например:
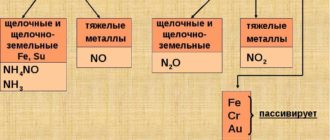
Алюминий не реагирует с азотной и серной концентрированными кислотами в обычных условиях. На поверхности алюминия образуется защитная оксидная плёнка, алюминий пассивируется. Алюминий реагирует с разбавленной азотной кислотой (2–3 моль/л) с образованием нитрата алюминия, нитрата аммония и воды:
Алюминий активно взаимодействует с растворами щелочей. Щёлочи растворяют оксидную плёнку на поверхности алюминия. Образуются соли, в которых алюминий находится в анионной форме, и выделяется водород:
Алюминий реагирует с растворами солей, восстанавливая катионы менее активных металлов (металлов, расположенных в ряду напряжений правее алюминия):
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЛЮМИНИЯ
Основным сырьём для производства алюминия служат бокситы, содержащие 32–60% глинозёма Al2O3. Алюминий получают электролизом расплава глинозёма Al2O3 в расплавленном криолите Na3AlF6. В электролизёре находится 6–8% глинозёма и 92– 94% криолита. Криолит в ходе электролиза не расходуется. Его получают искусственным путём – взаимодействием Al(ОН)3, HF и Na2CO3.
На катоде происходит восстановление алюминия: Al3+ + 3е– → Al0,
на аноде – окисление его оксида: 2Al2О3 – 12е– → 4Al3+ + 3O2,
а затем вторичная реакция на аноде: С + O2 → СO2 или 2С + O2 → 2СО
По широте применения сплавы алюминия занимают 2–е место после чугуна и стали. Алюминий – основа лёгких сплавов (например, дюралюмина, силумина), его применяют для производства различных ёмкостей и аппаратов, фольги и проволоки, в качестве раскислителя стали и восстановителя в алюмотермии.
Высокая электропроводность и коррозионная стойкость позволяют применять алюминий для изготовления электрических проводов, кабелей, конденсаторов.
Лёгкость, коррозионная стойкость алюминия и относительная нетоксичность его соединений позволяют применять алюминий для изготовления бытовой посуды, а алюминиевую фольгу – в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Из сплавов алюминия наиболее распространены дюралюмин, сокращённо – дюраль. Большую твёрдость дюралю по сравнению с чистым алюминием придают добавки меди, марганца и т. д. Дюралюмин – основной конструкционный материал в самолётостроении. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике.
Конспект урока по химии «Алюминий: характеристика и свойства». Выберите дальнейшее действие:
Источник: https://uchitel.pro/%D0%B0%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D0%B9-%D1%85%D0%B0%D1%80%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D1%81%D1%82%D0%B8%D0%BA%D0%B0-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BF%D0%BE/
Алюминий – общая характеристика элемента, химические свойства
Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий— лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
1. Алюминий легко реагирует с простыми веществами-неметаллами:
4Al + 3O2 = 2Al2O3
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3
2Al + N2 = 2AlN
2Al + 3S = Al2S3
4Al + 3С = Al4С3
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
2. Алюминий реагирует с водой
(после удаления защитной оксидной пленки):
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий вступает в реакцию со щелочами
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции: 2Al + 6H2O = 2Al(OH)3 + 3H2, NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно: 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты: Na[Al(OH)4] — тетрагидроксоалюминат натрия Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительная формула тетрагидроксосоединений следующая: Na[Al(OH)4(Н2О)2]
4. Алюминий легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
5. Алюминий восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Источник: http://himege.ru/alyuminij-xarakteristika-elementa/
Алюминиевые сплавы — марки, свойства и применение
Алюминий — серебристо-белый легкий парамагнитный металл. Впервые получен физиком из Дании Гансом Эрстедом в 1825 году. В периодической системе Д. И. Менделеева имеет номер 13 и символ Al, атомная масса равна 26,98.
Производство алюминия
Для производства алюминия используют бокситы — это горная порода, которая содержит гидраты оксида алюминия. Мировые запасы бокситов почти не ограничены и несоизмеримы с динамикой спроса.
Боксит дробят, измельчают и сушат. Получившуюся массу сначала нагревают паром, а затем обрабатывают щелочью — в щелочной раствор переходит большая часть оксида алюминия. После этого раствор длительно перемешивают.
На этапе электролиза глинозем подвергают воздействию электрического тока силой до 400 кА. Это позволяет разрушить связь между атомами кислорода и алюминия, в результате чего остается только жидкий металл.
После этого алюминий отливают в слитки или добавляют к нему различные элементы для создания алюминиевых сплавов.
Алюминиевые сплавы
Наиболее распространенные элементы в составе алюминиевых сплавов — медь, марганец, магний, цинк и кремний. Реже встречаются сплавы с титаном, бериллием, цирконием и литием.
Алюминиевые сплавы условно разделяют на две группы: литейные и деформируемые.
Для изготовления литейных сплавов расплавленный алюминий заливают в литейную форму, которая соответствует конфигурации получаемого изделия. Эти сплавы часто содержат значительные примеси кремния для улучшения литейных свойств.
Деформируемые сплавы сначала разливают в слитки, а затем придают им нужную форму.
Происходит это несколькими способами в зависимости от вида продукта:
- Прокаткой, если необходимо получить листы и фольгу.
- Прессованием, если нужно получить профили, трубы и прутки.
- Формовкой, чтобы получить сложные формы полуфабрикатов.
- Ковкой, если требуется получить сложные формы с повышенными механическими свойствами.
Марки алюминиевых сплавов
Для маркировки алюминиевых сплавов согласно ГОСТ 4784-97 пользуются буквенно-цифровой системой, в которой:
- А — технический алюминий;
- Д — дюралюминий;
- АК — алюминиевый сплав, ковкий;
- АВ — авиаль;
- В — высокопрочный алюминиевый сплав;
- АЛ — литейный алюминиевый сплав;
- АМг — алюминиево-магниевый сплав;
- АМц — алюминиево-марганцевый сплав;
- САП — спеченные алюминиевые порошки;
- САС — спеченные алюминиевые сплавы.
После первого набора символов указывается номер марки сплава, а следом за номером — буква, которая обозначает его состояние:
- М — сплав после отжига (мягкий);
- Т — после закалки и естественного старения;
- А — плакированный (нанесен чистый слой алюминия);
- Н — нагартованный;
- П — полунагартованный.
Алюминиево-магниевые сплавы
Эти пластичные сплавы обладают хорошей свариваемостью, коррозийной стойкостью и высоким уровнем усталостной прочности.
В алюминиево-магниевых сплавах содержится до 6% магния. Чем выше его содержание, тем прочнее сплав. Повышение концентрации магния на каждый процент увеличивает предел прочности примерно на 30 МПа, а предел текучести — примерно на 20 МПа.
При подобных условиях уменьшается относительное удлинение, но незначительно, оставаясь в пределах 30–35%.
Однако при содержании магния свыше 6% механическая структура сплава в нагартованном состоянии приобретает нестабильных характер, ухудшается коррозийная стойкость.
Для улучшения прочности в сплавы добавляют хром, марганец, титан, кремний или ванадий. Примеси меди и железа, напротив, негативно влияют на сплавы этого вида — снижают свариваемость и коррозионную стойкость.
Алюминиево-марганцевые сплавы
Это прочные и пластичные сплавы, которые обладают высоким уровнем коррозионной стойкости и хорошей свариваемостью.
Для получения мелкозернистой структуры сплавы этого вида легируют титаном, а для сохранения стабильности в нагартованном состоянии добавляют марганец. Основные примеси в сплавах вида Al-Mn — железо и кремний.
Сплавы алюминий-медь-кремний
Сплавы этого вида также называют алькусинами. Из-за высоких технических свойств их используют во втулочных подшипниках, а также при изготовлении блоков цилиндров. Обладают высокой твердостью поверхности, поэтому плохо прирабатываются.
Алюминиево-медные сплавы
Механические свойства сплавов этого вида в термоупрочненном состоянии порой превышают даже механические свойства некоторых низкоуглеродистых сталей. Их главный недостаток — невысокая коррозионная стойкость, потому эти сплавы обрабатывают поверхностными защитными покрытиями.
Алюминиево-медные сплавы легируют марганцем, кремнием, железом и магнием. Последний оказывает наибольшее влияние на свойства сплава: легирование магнием значительно повышает предел текучести и прочности. Добавление железа и никеля в сплав повышает его жаропрочность, кремния — способность к искусственному старению.
Алюминий-кремниевые сплавы
Сплавы этого вида иначе называют силуминами. Некоторые из них модифицируют добавками натрия или лития: наличие буквально 0,05% лития или 0,1% натрия увеличивает содержание кремния в эвтектическом сплаве с 12% до 14%. Сплавы применяются для декоративного литья, изготовления корпусов механизмов и элементов бытовых приборов, поскольку обладают хорошими литейными свойствами.
Сплавы алюминий-цинк-магний
Прочные и хорошо обрабатываемые. Типичный пример высокопрочного сплава этого вида — В95. Подобная прочность объясняется высокой растворимостью цинка и магния при температуре плавления до 70% и до 17,4% соответственно. При охлаждении растворимость элементов заметно снижается.
Основной недостаток этих сплавов — низкую коррозионную стойкость во время механического напряжения — исправляет легирование медью.
Авиаль
Авиаль — группа сплавов системы алюминий-магний-кремний с незначительными добавлениями иных элементов (Mn, Cr, Cu). Название образовано от сокращения словосочетания «авиационный алюминий».
Применять авиаль стали после открытия Д. Хансоном и М. Гейлером эффекта искусственного состаривания и термического упрочнения этой группы сплавов за счет выделения Mg2Si.
Эти сплавы отличаются высокой пластичностью и удовлетворительной коррозионной стойкостью. Из авиаля изготавливают кованые и штампованные детали сложной формы. Например, лонжероны лопастей винтов вертолетов. Для повышения коррозионной стойкости содержание меди иногда снижают до 0,1%.
Также сплав активно используют для замены нержавеющей стали в корпусах мобильных телефонов.
Химический состав алюминиевых сплавов
| Алюминиевые сплавы | ||||||||||||
| Марка | Массовая доля элементов, % | Плотность, кг/дм³ | ||||||||||
| ГОСТ | ISO209-1-89 | Кремний (Si) | Железо (Fe) | Медь (Cu) | Марганец (Mn) | Магний (Mg) | Хром (Cr) | Цинк (Zn) | Титан (Ti) | Другие | Алюминийне менее | |
| Каждый | Сумма | |||||||||||
| АД000 | A199,8 1080A | 0,15 | 0,15 | 0,03 | 0,02 | 0,02 | 0,06 | 0,02 | 0,02 | 99,8 | 2,7 | |
| АД00 1010 | A199,7 1070A | 0,2 | 0,25 | 0,03 | 0,03 | 0,03 | 0,07 | 0,03 | 0,03 | 99,7 | 2,7 | |
| АД00Е 1010Е | ЕА199,7 1370 | 0,1 | 0,25 | 0,02 | 0,01 | 0,02 | 0,01 | 0,04 | Бор:0,02 Ванадий+титан:0,02 | 0,1 | 99,7 | 2,7 |
В далеком прошлом из-за высокой стоимости алюминия его использовали для изготовления ювелирных изделий. Так, весы с алюминиевыми и золотыми чашами были подарены Д. И. Менделееву в 1889 г.
Когда себестоимость алюминия снизилась, мода на ювелирные изделия из этого металла прошла. Но и в наши дни его используют для изготовления бижутерии. В Японии, например, алюминием заменяют серебро при производстве национальных украшений.
Столовые приборы
По-прежнему пользуются популярностью столовые приборы и посуда из алюминия. В частности, в армии широко распространены алюминиевые фляжки, котелки и ложки.
Стекловарение
Алюминий широко применяют в стекловарении. Высокий коэффициент отражения и низкая стоимость вакуумного напыления — основные причины использования алюминия при изготовления зеркал.
Пищевая промышленность
Алюминий зарегистрирован как пищевая добавка Е173. Ее используют в качестве пищевого красителя, а также для сохранения продуктов от плесени. Е173 окрашивает кондитерские изделия в серебристый цвет.
Военная промышленность
Из-за небольшого веса и низкой стоимости алюминий широко применяют при изготовлении ручного стрелкового оружия — автоматов и пистолетов.
Ракетная техника
Алюминий и его соединения используют в качестве ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твердых ракетных топливах.
Алюмоэнергетика
В алюмоэнергетике алюминий используют для производства водорода и тепловой энергии, а также выработки электроэнергии в воздушно-алюминиевых электрохимических генераторах.
Источник: https://ferrolabs.ru/blog/alyuminiy-i-ego-splavy/
Состав и структура алюминия
Алюминий – это самый распространенный в земной коре металл. Его относят к легким металлам. Он обладает небольшой плотностью и массой. Кроме того, у него довольно низкая температура плавления. В то же время он обладает высокой пластичностью и показывает хорошие тепло- и электропроводные характеристики.
Кристаллическая решетка алюминияСтруктура алюминия
Предел прочности чистого алюминия составляет всего 90 МПа. Но, если в расплав добавить некоторые вещества, например, медь и ряд других, то предел прочности резко вырастает до 700 МПа. Такого же результат можно достичь, применяя термическую обработку.
Алюминий, обладающий предельно высокой чистотой – 99,99% производят для использования в лабораторных целях. Для применения в промышленности применяют технически чистый алюминий. При получении алюминиевых сплавов применяют такие добавки, как – железо и кремний. Они не растворяются в расплаве алюминия, а из добавка снижает пластичность основного материала, но в то же время повышает его прочность.
Внешний вид простого вещества
Структура этого металла состоит из простейших ячеек, состоящих из четырех атомов. Такую структуру называют гранецентрической.
Проведенные расчеты показывают, что плотность чистого металла составляет 2,7 кг на метр кубический.
Свойства и характеристики
Алюминий – это металл с серебристо-белой поверхности. Как уже отмечалось, его плотность составляет 2,7 кг/м3. Температура составляет 660°C.
Его электропроводность равняется 65% от меди и ее сплавов. Алюминий и бо́льшая часть сплавов из него стойко воспринимает воздействие коррозии. Это связано с тем, что на его поверхности образуется оксидная пленка, которая и защищает основной материал от воздействия атмосферного воздуха.
В необработанном состоянии его прочность равна 60 МПа, но после добавления определенных добавок она вырастает до 700 МПа. Твердость в этом состоянии достигает 250 по НВ.
Алюминий хорошо обрабатывается давлением. Для удаления наклепа и восстановления пластичности после обработки алюминиевые детали подвергают отжигу, при этом температура должна лежать в пределах 350°C.
Получение алюминиевого расплава, как и многих других материалов, происходит после того, как к исходному металлу подвели тепловую энергию. Она может быть подведена как непосредственно в него, так и снаружи.
Температура плавления алюминия напрямую зависит от уровня его чистоты:
-
- Сверхчистый алюминий плавится при температуре 660, 3°C.
- При количестве алюминия 99,5% температура плавления составляет 657°C.
- При содержании этого металла в 99% расплав можно получить при 643°C.
Алюминиевый расплавПроцесс получения алюминия
Алюминиевый сплав может включать в свой состав различные вещества, в том числе и легирующие. Их наличие приводит к снижению температуры плавления. Например, при наличии большого количества кремния, температура может понизиться до 500°C. На самом деле понятие температуры плавления относят к чистым металлам. Сплавы не обладают какой-то постоянной температурой плавления. Этот процесс происходит в определенном диапазоне нагрева.
В материаловедении существует понятие – температура солидус и ликвидус.
Первая температура обозначает ту точку, в которой начинается плавление алюминия, а вторая, показывает, при какой температуре, сплав будет окончательно расплавлен. В промежутке между ними сплав будет находиться в кашеобразном состоянии.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее.
Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов.
Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Относительно низкая температура плавления алюминия позволяет проводить эту операцию в домашних условия. Надо сразу отметить, что в качестве сырья в домашней мастерской использовать порошкообразную смесь слишком опасно. Поэтому в качестве сырья применяют или чушки, или нарезанную проволоку. Если к будущему изделию нет особых требований по качеству, то для плавления можно использовать все, что изготовленного из этого металла.
Плавка алюминия в самодельном горне
При этом не особо важно, будет сырье покрыто краской или нет. Когда происходит плавление алюминия, все посторонние вещества просто выгорят и будут удалены вместе со шлаком.
Для получения качественного результата плавки необходимо использовать материалы, которые называют флюсами. Они призваны решать задачу по связыванию и удалению из расплава посторонних примесей и загрязнений.
Домашний мастер, решивший в домашних условиях выполнять плавление алюминия должен отдавать себе отчет в том, что это довольно опасный процесс. И поэтому без применения средств защиты не обойтись. В частности, должны быть использованы перчатки, фартук, очки. Дело в том, что температура расплава лежит в пределах 600 градусов. Поэтому имеет смысл использовать средства защиты, которые применяют сварщики.
Использование средств защиты при плавке алюминия
Кстати, при плавлении алюминия и использовании очищающих химикатов необходимо защищать органы дыхания от продуктов их сгорания.
Выбор формы для литья
При выборе формы для отливки алюминия домашний мастер должен понимать, а для какой цели он обрабатывает алюминий. Если будущая отливка будет предназначена для использования в качестве припоя, то использовать, какие-то специальные формы, нет необходимости. Для этого можно использовать металлический лист, на котором можно остудить расплавленный металл.
Но если возникает необходимость получения даже простой детали, то мастер должен определиться с типом формы для литья.
Форму можно изготовить из гипса. Для этого, гипс в жидком состоянии заливают в обработанную маслом форму. После того, как начнет застывать, в него устанавливают литейную модель. Для того, чтобы в форму можно было залить расплавленный металл необходимо сформировать литник.
Для этого в форму устанавливают цилиндрическую деталь. Формы бывают разъемные и нет. Процесс изготовления разъемной формы усложняется тем, что модель будет находиться в двух полуформах. После застывания их разделяют, удаляют модель и соединяют снова. Форма готова к работе.
Кокиль для литья алюминия
Для получения качественных отливок целесообразно использовать металлические формы (кокили), но изготавливать их целесообразно только в заводских условиях.
Источник: https://stankiexpert.ru/spravochnik/materialovedenie/alyuminiy.html