Валентность алюминия (Al), формулы и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Алюминий – серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. Температуры плавления и кипения равны 660oС и -2500oС, соответственно.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающей очень сильным защитным действием.
Валентность алюминия в соединениях
Алюминий — тринадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IIIA группе. В ядре атома алюминия содержится 13 протонов и 14 нейтронов (массовое число равно 27). В атоме алюминия есть три энергетических уровня, на которых находятся 13 электронов (рис. 1).
Рис. 1. Строения атома алюминия.
Электронная формула атома алюминия в основном состоянии имеет следующий вид:
1s22s22p63s23p1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Так как на третьем энергетическом слое помимо 3s-подуровня есть еще и 3p-подуровень, две орбитали которого не заняты электронами, то пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3p-подуровня. Это означает, что для атома алюминия характерно наличие возбужденного состояния:
Наличие трех неспаренных электронов свидетельствует о том, что алюминий проявляет валентность III в своих соединения (AlIII2O3, AlIII(OH)3, AlIIICl3и др.). Валентность алюминия постоянная.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/valentnost/valentnost-alyuminiya/
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon |
Источник: https://infotables.ru/khimiya/1071-valentnost-khimicheskikh-elementov
Валентность. Определение валентности. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство)
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
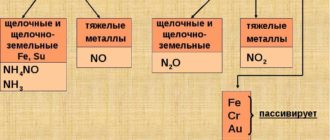
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH3.
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Источник: http://www.repetitor2000.ru/valentnost_01.html