Электронная конфигурация и строение атома кальция
В науках с физико-математическим уклоном для решения задач иногда необходимо знать атомарную структуру вещества. На уроках химии изучается каждый из элементов периодической системы (таблицы) Дмитрия Ивановича Менделеева и его строение атома. Кальций не является исключением. Однако для начала следует ознакомиться с основными понятиями и положениями о принципах формирования электронной оболочки для различных материалов, определяющей их важные свойства.
Общие сведения
Каждый химический элемент состоит из молекул, компонентами которых являются атомы. Последние состоят из следующих структурных единиц:
Последние вращаются вокруг ядра по орбитам, которые только отображаются на чертежах (графической схеме). Орбита — условное обозначение расстояния между ядром и электронами, удерживающимися посредством сил кулоновского притяжения.
На основании анализа структуры кристаллической решетки ученые открыли некоторые очень важные физико-химические свойства веществ. Например, благодаря изучению строения атома калия, его поместили в ряд щелочных металлов.
Он вступает в мгновенную реакцию с водой, образуя щелочь.
Ядро атома
Ядро — основной компонент атома, в котором сосредоточена основная масса. Оно имеет положительный заряд, притягивающий электроны, и состоит из протонов и нейтронов. Протий (легкий изотоп водорода) — единственный химический элемент, не содержащий нейтроны. Если ядро рассматривать в качестве частицы, то химики и физики называют его нуклидом, а нуклоны — совокупность положительно заряженных атомарных единиц.
Количество протонов обозначается литерой «Z», а нейтронов — N. Эти 2 коэффициента, как правило, равны. Однако иногда N превышает или меньше показателя Z. В этом случае говорят, что химический элемент является изотопом или изотоном, т. е. нестандартным. Чтобы их отличать между собой, следует запомнить 2 правила:
- Одинаковое Z и разное N — изотопы.
- Одинаковое N и разное Z — изотоны.
Число «Z» соответствует порядковому номеру в таблице Д. И. Менделеева. Алгебраическая сумма Z и N эквивалентна массовому атомарному числу А, которое также указывается в периодической системе. Оно имеет и другое название — молекулярная масса химического элемента. Кроме того, у ядра существуют и другие характеристики. К основным из них относятся следующие:
Коэффициент Z определяет уровень электрического заряда. Впервые его открыл ученый Г. Мозли в 1913 году опытным путем, измеряя длину электромагнитной волны водорода.
Для других элементов была установлена такая же зависимость от порядкового номера элемента. Заряд протонов, входящих в состав ядра, действует на электроны, которые вращаются вокруг него.
Следует отметить, что положительная частица не может притянуть отрицательную, поскольку поле, создающее связь между ними, не способно это сделать.
В некоторых случаях заряд не может удержать электрон. При этом последний «отрывается» с орбитали. В результате такого процесса образуется ион, т. е. атом, который может взаимодействовать с другими.
Структуру строения можно интерпретировать с планетами, вращающимися вокруг Солнца. Последнее не может притянуть их, поскольку недостаточно силы притяжения, которая зависит от расстояния и массы.
Следующей характеристикой ядра является масса. Она измеряется в атомарных единицах массы — а. е. м. Одна «а.е.м.» эквивалентна 1/12 массы атома углерода, который обозначается литерой «С».
Информация об электронах
Электрон — элементарная частица, имеющая отрицательный заряд. Ее масса намного меньше, чем у ядра. У каждой частицы есть своя орбиталь, которая показывает валентность химического элемента. Электроны не только входят в состав атома, но и бывают свободными, т. е. влияют на электрическую проводимость веществ. На основании этого утверждения ученые сделали вывод, что материалы могут классифицироваться на проводники, полупроводники и диэлектрики.
Первые имеют свободные электроны, во вторых они появляются только при воздействии каких-либо внешних сил, способных «вырвать» отрицательно заряженные элементарные частицы с орбитали. В диэлектриках или изоляторах они отсутствуют.
Физико-химические свойства кальция
Кальций — химический элемент, относящийся к щелочно-земельным металлам. Он обозначается литерой «Са». В периодической системе находится под порядковым номером «20». Кроме того, обладает атомарной массой, равной 40 а. е. м. (А = 40 а. е. м.). Основным его источником в природе является карбонат кальция или мел, химическая формула которого имеет вид CaCO3.
Температура плавления Са составляет 854 градусов по шкале Цельсия. Под высоким давлением пропускает электрический ток в одном направлении. При взаимодействии с кислородом, входящим в состав атмосферного воздуха, окисляется (Ca2O). Примером окислительной реакции является мел, которые крошится, а при ударе — разбивается на части.
В лабораторных условиях его можно получить при электролизе расплавленного CaCl2. Последнее вещество называется хлоридом кальция. Электролиз — физико-химический процесс, при котором через какое-либо вещество пропускают постоянный ток. В этом случае ионы (заряжены положительно) направляются к электроду (катоду), имеющему отрицательный потенциал (-), а катионы — к положительному (аноду). При этом распад хлорида кальция можно записать в таком виде: ион (Ca2+) и катион (Cl 2 2-).
Схема строения атома и электронная конфигурация кальция определяют его другие химические свойства. Он реагирует с большинством веществ, являющимися сложными и простыми. Сохранить его в чистом виде довольно сложно. Например, чтобы сберечь «чистый» Ca, нужно покрыть его парафином или керосином в емкости без дополнительного доступа кислорода.
Электронная оболочка
Электронная оболочка атома — форма, позволяющая научным путем доказать возможность взаимодействия элемента с другими веществами. Принципы ее образования имеют следующие формулировки:
- Минимум энергии: определяет энергетический обмен между электронами, заполняющими орбитали.
- Паули: на орбитали могут находиться только 2 отрицательно заряженные частицы с противоположными спинами (векторами вращения).
- Хунда: заполнение орбиталей с максимальным количеством электронов с учетом спинов.
Ядро атома имеет положительный заряд «+20», который соответствует порядковому номеру в периодической таблице элементов. Количество Z = 20 и N = 20. Следовательно, вокруг ядра двигаются 20 электронов, поскольку количество положительных нуклонов равняется числу отрицательно заряженных частиц.
Схематически обозначение структуры, состоящей из четырех орбит, имеет такой вид: +20 Ca)2)8)8)2. В этом случае можно записать электронную конфигурацию элемента: 1 s2 2 s2 2 p6 3 s2 3 p6 4 s2. Если сложить показатели степеней подуровней орбит, получается «20», т. е. 2+2+6+2+6+2. Электронная формула заполняется по такому алгоритму:
- Выписывается порядковый номер: 20.
- На первом подуровне должно быть не более 2: 1 s2. Первая орбиталь заполнена.
- Вторая орбита (до 6 на подуровне 2р и 2 на 2s): 2s22p6.
- Третья состоит из двух подуровней, на каждом из которых может находиться 2 и 6 частиц соответственно: 3s2 3 p6 .
- Четвертая также включает 2 подуровня 4s и 4p, но частиц хватает только на 4s: 4 s2.
- Проверка количества электронов: 2+2+6+2+6+2 = 20 (результат соответствует действительности, т. е. равен Z).
На основании электронной конфигурации можно определить еще один параметр Cа, который называется валентностью. Она равна 2, поскольку последняя орбиталь имеет только 2 электрона.
Таким образом, кальций является двухвалентным элементом и обладает физическими и химическими свойствами, которые присущи щелочно-земельным металлам.
Источник: https://1001student.ru/himiya/elektronnaya-konfiguratsiya-i-stroenie-atoma-kaltsiya.html
Реагирует ли медь с водой
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения.
Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки.
Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла.
Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения.
При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К.
Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот.
Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570.
Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным.
Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности.
Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде.
Что примечательно, она находится в одной группе с благородными металлами.
Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность.
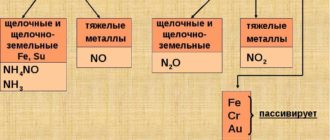
В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву.
Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится.
Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат.
Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью.
Такими соединениями являются двойные соли меди и аммиачные смеси.
И те и другие нашли широкое применение в различных отраслях промышленности.
Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции.
Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой.
Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Как сварить медные провода в домашних условиях
Шина электротехническая медная
Источник: https://steelfactoryrus.com/reagiruet-li-med-s-vodoy/
Оксид меди (II), свойства, получение, химические реакции
Оксид меди (II) – неорганическое вещество, имеет химическую формулу CuO.
Краткая характеристика оксида меди (II)
Физические свойства оксида меди (II)
Получение оксида меди (II)
Химические свойства оксида меди (II)
Химические реакции оксида меди (II)
Применение и использование оксида меди (II)
Краткая характеристика оксида меди (II):
Оксид меди (II) – неорганическое вещество черного цвета.
Так как валентность меди меняется и равна одному, двум или трем, то оксид меди содержит соответственно два атома меди и один атом кислорода, один атом меди и один атом кислорода, два атома меди и три атома кислорода.
Оксид двухвалентной меди содержит соответственно один атом меди и один атом кислорода.
Химическая формула оксида меди (II) CuO.
Порошок. Не растворяется в воде.
Физические свойства оксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | CuO |
| Синонимы и названия иностранном языке | меди окись (устар. рус.)сopper (II) oxide (англ.)тенорит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | черный порошок |
| Цвет | черный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 6310 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 6,31 |
| Температура кипения, °C | 2000 |
| Температура плавления, °C | 1447 |
| Температура разложения, °C | 800 |
| Молярная масса, г/моль | 79,545 |
* Примечание:
— нет данных.
Оксид меди (II) получается в результате следующих химических реакций:
1. окисления меди:
2Cu + O2 → CaО.
2. термического разложения гидроксида меди (II), нитрата меди (II), карбоната меди (II):
Cu(OH)2 → CuО + H2O (to);
2Cu(NO3)2 → 2CuО + 4NO2 + O2 (to);
CuCO3 → CuО + CO2 (to).
3. нагревания малахита:
Cu2CO3(OH)2 → 2CuО + CO2 + H2O (to).
Оксид меди (II) относится к основным оксидам.
Химические свойства оксида меди (II) аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида меди (II)с водородом:
CuО + H2 → Cu + H2О (t = 300 oC).
В результате реакции образуется медь и вода.
2. реакция оксида меди (II) с углеродом:
CuО + С → Cu + СО (t = 1200 oC).
В результате реакции образуется медь и оксид углерода.
3. реакция оксида меди (II)с серой:
CuО + 2S → Cu + S2О (t = 150-200 oC).
Реакция протекает в вакууме. В результате реакции образуется медь и оксид серы.
4. реакция оксида меди (II)с алюминием:
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 oC).
В результате реакции образуется медь и оксид алюминия.
5. реакция оксида меди (II)с медью:
CuО + Cu → Cu2О (t = 1000-1200 oC).
В результате реакции образуется оксид меди (I).
6. реакция оксида меди (II)с оксидом лития:
CuО + Li2О → Li2CuО2 (t = 800-1000 oC, О2).
Реакция протекает в токе кислорода. В результате реакции образуется купрат лития.
7. реакция оксида меди (II)с оксидом натрия:
CuО + Na2О → Na2CuО2 (t = 800-1000 oC, О2).
Реакция протекает в токе кислорода. В результате реакции образуется купрат натрия.
8. реакция оксида меди (II)с оксидом углерода:
CuО + СО → Cu + СО2.
В результате реакции образуется медь и оксид углерода (углекислый газ).
9. реакция оксида меди (II)с оксидом железа:
CuО + Fe2O3 → CuFe2О4 (to).
В результате реакции образуется соль – феррит меди. Реакция протекает при прокаливании реакционной смеси.
10. реакция оксида меди (II)с плавиковой кислотой:
CuO + 2HF → CuF2 + H2O.
В результате химической реакции получается соль – фторид меди и вода.
11. реакция оксида меди (II)с азотной кислотой:
CuO + 2HNO3 → 2Cu(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат меди и вода.
Аналогично проходят реакции оксида меди (II)и с другими кислотами.
12. реакция оксида меди (II)с бромистым водородом (бромоводородом):
CuO + 2HBr → CuBr2 + H2O.
В результате химической реакции получается соль – бромид меди и вода.
13. реакция оксида меди (II)с йодоводородом:
CuO + 2HI → CuI2 + H2O.
В результате химической реакции получается соль – йодид меди и вода.
14. реакция оксида меди (II)с гидроксидом натрия:
CuO + 2NaOH → Na2CuO2 + H2O.
В результате химической реакции получается соль – купрат натрия и вода.
15. реакция оксида меди (II)с гидроксидом калия:
CuO + 2KOH → K2CuO2 + H2O.
В результате химической реакции получается соль – купрат калия и вода.
16. реакция оксида меди (II)с гидроксидом натрия и водой:
CuO + 2NaOH + H2O → Na2[Cu2(OН)]2 (t = 100 oC).
Гидрокосид натрия растворен в воде. Раствор гидроксида натрия в воде 20-30 %. Реакция протекает при киппении. В результате химической реакции получается тетрагидроксокупрат натрия.
17. реакция оксида меди (II)с надпероксидом калия:
2CuO + 2KO2 → 2KCuO2 + О2 (t = 400-500 oC).
В результате химической реакции получается соль – купрат (III) калия и кислород.
18. реакция оксида меди (II)с пероксидом калия:
2CuO + 2K2O2 → 2KCuO2 (t = 700 oC).
В результате химической реакции получается соль – купрат (III) калия.
19. реакция оксида меди (II)с пероксидом натрия:
2CuO + 2Na2O2 → 2NaCuO2 (t = 700 oC).
В результате химической реакции получается соль – купрат (III) натрия.
20. реакция оксида меди (II)с аммиаком:
3CuO + 2NH3 → N2 + 3Cu + 3H2O (t = 500-550 oC).
Аммиак пропускают через нагретый оксид меди (II). В результате химической реакции получается азот, медь и вода.
6CuO + 4NH3 → 2Cu3N + N2 + 6H2O (t = 250-300 oC).
В результате химической реакции получается нитрид меди, азот и вода.
21. реакция оксида меди (II) и йодида алюминия:
6CuO + 4AlI3 → 6CuI + 2Al2O3 + 3I2 (t = 230 oC).
В результате химической реакции получаются соль – йодид меди, оксид алюминия и йод.
Применение и использование оксида меди (II):
Оксид меди используется для производства стекла и эмалей для придания им соответствующей окраски (зеленой, синей, медно-рубиновой).
Примечание: Фото //www.pexels.com, //pixabay.com
карта сайта
оксид меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида меди
реакции с оксидом меди
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/oksid-medi-ii-svoystva-poluchenie-himicheskie-reaktsii/
Органическая химия — Химия в школе № 302 Фрунзенского района Санкт-Петербурга
Для этого газлибо поджигают — горение алканов сопровождается синим пламенем, либо пропускаютчерез раствор перманганата калия. Алканы не окисляются перманганатом калия нахолоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а)Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль.
СН2=СН2 + [О] CH2ОН-CH2ОН
б)Обесцвечивание бромной воды:
C2H4 + Br2 —> C2H4Br2
а) Обесцвечивание перманганата калия (реакция Вагнера).
C2H2 + [О] —> НOOC-COOН (щавелевая кислота)
б) Обесцвечивание бромной воды:
C2H2 + 2Br2 —> C2H2Br4
в)Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Только для алкинов с тройной связью у крайнего атомауглерода (!)
C2H2 + 2[Ag(NH3)2]OH ——> Ag2C2↓+ 4NH3 + 2H2O
Получившийся ацетиленид серебра (I) выпадает восадок.
Алкины, у которых тройная связь в середине (R-C≡C-R)в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атомметалла, подобно кислотам — обусловлено тем, что атом углерода находится всостоянии sp-гибридизации и электроотрицательность атома углерода в такомсостоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а)Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
CH3-CHO + 2[Ag(NH3)2]OH —> CH3-COOH+ 2Ag↓ + 4NH3 + H2O (реакция идет при нагревании)
Примечание: реакциейсеребряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH.При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьинаякислота — единственная из карбоновых кислот, содержащая одновременноальдегидную и карбоксильную группы:
Входе реакции метановая кислота окисляется до угольной, которая разлагается науглекислый газ и воду:
HCOOH + 2[Ag(NH3)2]OH —> CO2+ 2H2O + 4NH3 + 2Ag↓ (реакция идет при нагревании)
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого ксвежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH —> Na2SO4 +Cu(OH)2↓
CH3-CHO+ 2Cu(OH)2 —> CH3-COOH + Cu2O↓ + 2H2O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в)Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистойкислоты раствор окрашивается в светло-фиолетовый цвет.
Спирты поколичеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- имногоатомных спиртов реакции различны.
Качественные реакции наодноатомные спирты
а)Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленнымоксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой,раствор становится фиолетовым:
CH3-CH2-OH+ CuO —> CH3-CHO + Cu + H2O
б) Взаимодействие с натрием.
2CH3-CH2-OH + 2Na —> 2CH3-CH2-ONa + H2
Качественныереакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидовмногоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
Кпримеру, при приливании глицерина образуется глицерат меди (II) (хелатный комплекс темно-синего цвета):
б) Взаимодействие с натрием.
а)Лакмус.
Красное окрашивание
Качественные реакции на муравьиную кислоту
а)Реакция серебряного зеркала.
б)Взаимодействие с концентрированной серной кислотой.
При добавлении концентрированной серной кислоты H2SO4 к раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH + H2SO4—> CO + H2O
Угарный газ можно поджечь. Горит синем пламенем:
2CO + O2 —> 2CO2
в) Окисление перманганатом калия.
Качественная реакция на олеиновую кислоту (кислота содержит двойную связь)
а) Обесцвечивание бромной воды
Качественная реакция на щавелевую кислоту H2C2O4 или HOOC-COOH
а) Взаимодействие с растворами солей меди (II)
Придобавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадококсалата меди (II):
Cu2+ + C2O42- ——>CuC2O4↓
б) Разложение концентрированной серной кислотой.
H2C2O4 + H2SO4—>CO + CO2 + H2O
Качественные реакции на амины
а)Лакмус
Синий цвет
б) Взаимодействие с галогеноводородами (HHal)
Образуют соли с галогеноводородами — послевыпаривания твердый осадок.
Качественные реакции на анилин
а) Взаимодействие с бромной водой.
C6H5NH2 +3Br2 —> C6H2NH2(Br)3↓+ 3HBr
б) Взаимодействие с галогеноводородами (HHal)
Образуют соли с галогеноводородами — после выпаривания твердый осадок.
в) Взаимодействие с хлорной известью.
Сиреневая окраска.
Качественные реакции на фенол
а) Взаимодействие с хлоридом железа (III)
Образуется фиолетовый комплекс.
б) Взаимодействие с бромом.
Осадокжелтоватого цвета 2,4,6 —трибромфенол
C6H5OH + 3Br2 —>C6H2OH(Br)3↓ +3HBr
в) Взаимодействие с альдегидами.
Фенолы дают фенол-альдегидные смолы при реакции сальдегидом в кислой среде. При этом образуются мягкие пористые массыфенол-альдегидных смол (реакция поликонденсации).
г) Взаимодействие фенола с натрием.
2C6H5OH + 2Na—> 2C6H5ONa + H2
Вещества,содержащие хлор, могут окрашивать пламя в зеленый цвет. Для этого нужнообмакнуть медную проволоку в алкилхлориде и поднести к пламени (пробаБельштейна).
Большинствоуглеводов имеют альдегидные и гидроксильные группы, поэтому для них характернывсе реакции альдегидов и многоатомных спиртов.
Качественная реакция на крахмал
а) Взаимодействие с йодом.
Крахмал в присутствии иода окрашивается втемно-синий цвет. При нагревании окраска исчезает, при охлаждении появляетсявновь.
Белкивыявляются в основном на реакциях, основанных на окрасках.
а) Ксантопротеиновая реакция
— Взаимодействие с концентрированной азотной кислотой.
(OH)C6H4CH(NH2)COOH + HNO3 —> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O
Выпадает осадок желтого цвета.
— Взаимодействие со щелочным раствором.
(OH)C6H3(NO2)CH(NH2)COOH+ 2NaOH —> (ONa)C6H3(NO2)CH(NH2)COONa+ H2O
Оранжевое окрашивание раствора.
б) Биуретовая реакция для обнаруженияпептидной связи (CO-NH):
Белок + CuSO4 + NaOH —> красно-фиолетовое окрашивание
Источник: https://www.sites.google.com/site/school302chemistry/opyty/kacestvennye-reakcii-10-klass
Оксид меди (I, II, III): свойства, получение, применение :
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.
Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240оС. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего.
Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.
), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.
Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100оС. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100оС. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.
Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400оС, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
Источник: https://www.syl.ru/article/97628/oksid-medi-i-ii-iii-svoystva-poluchenie-primenenie
Химические свойства оксида меди
Оксид меди (I) — Cu2O. В природе его можно встретить в виде минерала куприта. Также известны такие его названия, как закись меди, гемиоксид меди и оксид димеди. Оксид меди (I) относится к группе амфотерных оксидов.