Как определить степень окисления. Определение степени окисления соединений
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
«>
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
«>
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности.
У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента.
Сумма всех степеней окисления должна быть равна нулю.
«>
Пример определения в серной кислоте
Формула данного соединения имеет вид H2SO4. У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
«>
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Мы уже знаем о существовании заряженных частиц-ионов. Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента.
Записи Na+, Ca2+, Al3+ означают, что атомы данных элементов потеряли соответственно 1, 2, 3 е-, а записи F-, O2-, N3- означают, что атомы данных элементов приобрели соответственно 1, 2, и 3е- . Степени окисления элементов. Для определения состава молекулярных соединений (SO2, NH3, CO2 и т. д. ) и ионных простых соединений (Na2O, Na2SO4 и т. д.) .
При оценке степени окисления элементов соединения представляют расщеплёнными на одноатомные ионы. Степень окисления-это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, причём знак ставится перед числом: -1, -2, +3, в отличии от заряда иона, где знак ставится после числа.
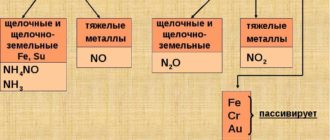
r/>В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0. Степени окисления металлов в соединениях всегда положительные, высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключая некоторые элементы: золото Au+3 (I группа) , Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru. Степени неметаллов могут быть как положительными так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и +, и — ( об этом вы узнаете при изучении ряда электроотрицательностей) . Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое ( число электронов соответствует номеру группы) . Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
При определении степеней окисления необходимо использовать следующие правила:
Источник: https://znaivse.biz/obrazovanie/kak-opredelit-stepen-okisleniya-20-01-2020.html
Как определить степень окисления: таблица Менделеева и алгоритм действий :
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Источник: https://www.syl.ru/article/287818/new_kak-opredelit-stepen-okisleniya-tablitsa-mendeleeva-i-algoritm-deystviy
Медь — химические свойства
Медь расположена в 11 группе Периодической системы химических элементов Д.И. Менделеева.
В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl3] + H2
Источник: http://himege.ru/med-ximicheskie-svojstva/
Степени окисления — это какая величина? Как определить степень окисления элементов?
Такой предмет школьной программы как химия вызывает многочисленные затруднения у большинства современных школьников, мало кто может определить степень окисления в соединениях. Наибольшие сложности у школьников, которые изучают неорганическую химию, то есть учеников основной школы (8-9 классы). Непонимание предмета приводит к возникновению неприязни у школьников к данному предмету.
Педагоги выделяют целый ряд причин такой «нелюбви» учеников средних и старших классов к химии: нежелание разбираться в сложных химических терминах, неумение пользоваться алгоритмами для рассмотрения конкретного процесса, проблемы с математическими знаниями. Министерством образования РФ были внесены серьезные изменение в содержание предмета. К тому же «урезали» и количество часов на преподавание химии. Это негативно сказалось на качестве знаний по предмету, снижению интереса к изучению дисциплины.
Какие темы курса химии даются школьникам труднее всего?
По новой программе в курс учебной дисциплины «Химия» основной школы включено несколько серьезных тем: периодическая таблица элементов Д. И. Менделеева, классы неорганических веществ, ионный обмен. Труднее всего дается восьмиклассникам определение степени окисления оксидов.
Правила расстановки
Прежде всего ученики должны знать, что оксиды являются сложными двухэлементными соединениями, в состав которых включен кислород. Обязательным условием принадлежности бинарного соединения к классу оксидов является расположение кислорода вторым в данном соединении.
Рассчитать такой показатель в любых формулах данного класса получится, только если школьник владеет определенным алгоритмом.
Алгоритм для кислотных оксидов
Для начала заметим, что степени окисления это численные выражения валентности элементов. Кислотные оксиды образованы неметаллами либо металлами с валентностью от четырех до семи, вторым в таких оксидах обязательно стоит кислород.
В оксидах валентность кислорода всегда соответствует двум, определить ее можно по периодической таблице элементов Д. И. Менделеева.
Такой типичный неметалл как кислород, находясь в 6 группе главной подгруппы таблицы Менделеева, принимает два электрона, чтобы полностью завершить свой внешний энергетический уровень.
Неметаллы в соединениях с кислородом чаще всего проявляют высшую валентность, которая соответствует номеру самой группы. Важно напомнить, что степень окисления химических элементов это показатель, предполагающий положительное (отрицательное) число.
Неметалл, стоящий в начале формулы, обладает положительной степенью окисления. Неметалл кислород же в оксидах стабилен, его показатель -2. Для того чтобы проверить достоверность расстановки значений в кислотных окислах, придется перемножить все поставленные вами цифры на индексы у конкретного элемента. Расчеты считаются достоверными, если суммарный итог всех плюсов и минусов поставленных степеней получается 0.
Составление двухэлементных формул
Степень окисления атомов элементов дает шанс создавать и записывать соединения из двух элементов. При создании формулы, для начала оба символа прописывают рядом, обязательно вторым ставят кислород.
Сверху над каждым из записанных знаков прописывают значения степеней окисления, затем между найденными числами находится то число, что будет без какого-либо остатка делиться на обе цифры.
Данный показатель необходимо поделить по отдельности на числовое значение степени окисления, получая индексы для первого и второго компонентов двухэлементного вещества. Высшая степень окисления равна численно значению высшей валентности типичного неметалла, идентична номеру группы, где стоит неметалл в ПС.
Алгоритм постановки числовых значений в основных оксидах
Подобными соединениями считаются оксиды типичных металлов. Они во всех соединениях имеют показатель степени окисления не более +1 либо +2. Для того чтобы понять, какую будет иметь степень окисления металл, можно воспользоваться периодической системой. У металлов основных подгрупп первой группы, данный параметр всегда постоянный, он аналогичен номеру группы, то есть +1.
Металлы основной подгруппы второй группы также характеризуются стабильной степенью окисления, в цифровом выражении +2. Степени окисления оксидов в сумме с учетом их индексов (числа) должны давать нуль, поскольку химическая молекула считается нейтральной, лишенной заряда, частицей.
Расстановка степеней окисления в кислородсодержащих кислотах
Кислоты представляют собой сложные вещества, состоящими из одного или нескольких атомов водорода, которые связаны с каким-то кислотным остатком. Учитывая, что степени окисления это цифровые показатели, для их вычисления потребуются некоторые математические навыки. Такой показатель для водорода (протона) в кислотах всегда стабилен, составляет +1. Далее можно указать степень окисления для отрицательного иона кислорода, она также стабильная, -2.
Лишь только после этих действий, можно вычислять степень окисления у центрального компонента формулы. В качестве конкретного образца рассмотрим определение степени окисления элементов в серной кислоте H2SO4. Учитывая, что в молекуле данного сложного вещества содержится два протона водорода, 4 атома кислорода, получаем выражение такого вида +2+X-8=0. Для того чтобы в сумме образовывался ноль, у серы будет степень окисления +6
Расстановка степеней окисления в солях
Соли представляют собой сложные соединения, состоящие из ионов металла и одного либо нескольких кислотных остатков. Методика определения степеней окисления у каждого из составных частей в сложной соли такая же, как и в кислородсодержащих кислотах. Учитывая, что степень окисления элементов — это цифровой показатель, важно правильно обозначить степень окисления металла.
Если металл, образующий соль, располагается в главной подгруппе, его степень окисления будет стабильной, соответствует номеру группы, является положительной величиной.
Если же в соли содержится металл подобной подгруппы ПС, проявляющий разные валентности, определить валентность металла можно по кислотному остатку.
После того как установлена будет степень окисления металла, ставят степень окисления кислорода (-2), далее вычисляют степень окисления центрального элемента, воспользовавшись химическим уравнением.
В качестве примера рассмотрим определение степеней окисления у элементов в нитрате натрия (средней соли). NaNO3. Соль образована металлом главной подгруппы 1 группы, следовательно, степень окисления натрия будет +1. У кислорода в нитратах степень окисления составляет -2. Для определения численного значения степени окисления составляет уравнение +1+X-6=0. Решая данное уравнение, получаем, что X должен быть +5, это и есть степень окисления азота.
Основные термины в ОВР
Для окислительного, а также восстановительного процесса существуют специальные термины, которые обязаны выучить школьники.
Степень окисления атома это его непосредственная способность присоединять к себе (отдавать иным) электроны от каких-то ионов или же атомов.
Окислителем считают нейтральные атомы или заряженные ионы, в ходе химической реакции присоединяющие себе электроны.
Восстановителем станут незаряженные атомы или заряженные ионы, что в процессе химического взаимодействия теряют собственные электроны.
Окисление представляется как процедура отдачи электронов.
Восстановление связано с принятием дополнительных электронов незаряженным атомом или ионом.
Окислительно-восстановительны процессом характеризуется реакция, в ходе которой обязательно меняется степень окисления атома. Это определение позволяет понять, как можно определить, является ли реакция ОВР.
Правила разбора ОВР
Пользуясь данным алгоритмом, можно расставить коэффициенты в любой химической реакции.
-
Для начала нужно расставить в каждом химическом веществе степени окисления. Учтите, что в простом веществе степень окисления равна нулю, так как отсутствует отдача (присоединение) отрицательных частичек. Правила расстановки степеней окисления в бинарных и трехэлементных веществ были нами рассмотрены выше.
-
Затем нужно определить те атомы либо ионы, у которых в ходе произошедшего превращения, изменились степени окисления.
-
Из левой части записанного уравнения выделяют атомы либо заряженные ионы, которые поменяли свои степени окисления. Это необходимо для составления баланса. Над элементами обязательно указывают их значения.
-
Далее записываются те атомы либо ионы, которые образовались в ходе реакции, указывается знаком + количество принятых атомом электронов, — число отданных отрицательных частиц. Если после процесса взаимодействия уменьшаются степени окисления. Это означает, что электроны были приняты атомом (ионом). При повышении степени окисления атом (ион) в ходе реакции отдают электроны.
-
Наименьшее общее число делят сначала на принятые, потом на отданные в процессе электроны, получают коэффициенты. Найденные цифры и будут искомыми стереохимическими коэффициентами.
-
Определяют окислитель, восстановитель, процессы, протекающие в ходе реакции.
-
Последним этапом будет расстановка стереохимических коэффициентов в рассматриваемой реакции.
Пример ОВР
Рассмотрим практическое применение данного алгоритма на конкретной химической реакции.
Fe+CuSO4=Cu+FeSO4
Рассчитываем показатели у всех простых и сложных веществ.
Так как Fe и Cu являются простыми веществами, их степень окисления равна 0. В CuSO4, то Cu+2, тогда у кислорода-2, а у серы +6. В FeSO4: Fe +2, следовательно, для О-2, по расчетам S +6.
Теперь ищем элементы, что смогли поменять показатели, в нашей ситуации ими окажутся Fe и Cu.
Так как после реакции значение у атома железа стала +2, в реакции было отдано 2 электрона. Медь поменяла свои показатели с +2 до 0, следовательно, медь приняла 2 электрона. Теперь определяем количество принятых и отданных электронов атомом железа и катионом двухвалентной меди. В ходе превращения взято два электрона катионом двухвалентной меди, столько же электронов отдано атомом железа.
В данном процессе нет смысла определять минимальное общее кратное, поскольку принято и отдано в ходе превращения равное количество электронов. Стереохимические коэффициенты будут также соответствовать единице. В реакции свойства восстановителя будет проявлять железо, при этом оно окисляется. Катион двухвалентной меди восстанавливается до чистой меди, в реакции у нее высшая степень окисления.
Применение процессов
Формулы степени окисления должны быть известны каждому школьнику 8-9 класса, так как данный вопрос включен в задания ОГЭ. Любые процессы, которые протекают с окислительными, восстановительными признаками, играют важное значение в нашей жизни. Без них невозможны обменные процессы в организме человека.
Источник: https://FB.ru/article/241628/stepeni-okisleniya---eto-kakaya-velichina-kak-opredelit-stepen-okisleniya-elementov/amp
Журавлева Т. | Комплексные соединения | Журнал «Химия» № 6/2005
Цели. Сформировать представления о составе, строении, свойствах и номенклатуре комплексных соединений; развить навыки определения степени окисления у комплексообразователя, составления уравнений диссоциации комплексных соединений.
Новые понятия: комплексное соединение, комплексообразователь, лиганд, координационное число, внешняя и внутренняя сферы комплекса.
Оборудование и реактивы.
Штатив с пробирками, концентрированный раствор аммиака, растворы сульфата меди(II), нитрата серебра, гидроксида натрия.
ХОД УРОКА
Лабораторный опыт. К раствору сульфата меди(II) прилить раствор аммиака. Жидкость окрасится в интенсивный синий цвет.
Что произошло? Химическая реакция? До сих пор мы не знали, что аммиак может реагировать с солью. Какое вещество образовалось? Каковы его формула, строение, название? К какому классу соединений его можно отнести?Может ли аммиак реагировать с другими солями? Есть ли соединения, аналогичные этому? Ответить на эти вопросы нам и предстоит сегодня.
Чтобы лучше изучить свойства некоторых соединений железа, меди, серебра, алюминия, нам потребуются знания о комплексных соединениях.
Продолжим наш опыт. Полученный раствор разделим на две части. К одной части прильем щелочь. Осадка гидроксида меди(II) Cu(OH)2 не наблюдается, следовательно, в растворе нет двухзарядных ионов меди или их слишком мало. Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами OH–.
В то же время ионы остаются неизменными. В этом можно убедиться, прибавив к аммиачному раствору раствор хлорида бария. Тотчас же выпадет белый осадок BaSO4.
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов [Cu(NH3)4]2+, образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4]2+ связываются с ионами , и из раствора выделяются темно-синие кристаллы, состав которых выражается формулой [Cu(NH3)4]SO4•H2O.
Комплексными
называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворах.
Формулы молекул или ионов комплексных соединений обычно заключают в квадратные скобки. Комплексные соединения получают из обычных (некомплексных) соединений.
Примеры получения комплексных соединений
| CuSO4 + 4NH3 | [Cu(NH3)4] SO4 | [Cu(NH3)4]2+ |
| Fe(CN)2 + 4KCN | K4[Fe(CN)6] | [Fe(CN)6]4– |
| PtCl2 + 2NH3 | [Pt(NH3)2Cl2] | – |
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя.
Пример комплексного соединения
Рассмотренное в примере соединение [Cu(H2O)4)]SO4•H2O или CuSO4•5Н2О – это кристаллогидрат сульфата меди(II).
Определим составные части других комплексных соединений, например K4[Fe(CN)6].
(Справка. Вещество с формулой HCN – это синильная кислота. Соли синильной кислоты называют цианидами.)
Комплексообразователь – ион железа Fe2+, лиганды – цианид-ионы СN–, координационное число равно шести. Все, что записано в квадратных скобках, – внутренняя сфера. Ионы калия образуют внешнюю сферу комплексного соединения.
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения.
С другой – между центральным атомом и лигандамиможет образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония.
Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионывнешней сферы. Например:
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + .
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава:
[Cu(NH3)4]SO4 + BaCl2 = [Cu(NH3)4]Cl2 + BaSO4.
Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы.
Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Наиболее типичными комплексообразователями являются катионы d-элементов.
Лигандами
могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO;
б) простые ионы – F–, Cl–, Br–, I–, H–, H+;
в) сложные ионы – CN–, SCN–, NO2–, OH–.
Pассмотрим таблицу, в которой приведены координационные числа некоторых комплексообразователей.
Таблица
| 2 | Cu+, Ag+, Au+ |
| 4 | Cu2+, Hg2+, Sn2+, Pt2+, Pb2+, Ni2+, Co2+, Zn2+, Au3+, Al3+ |
| 6 | Fe2+, Fe3+, Co2+, Co3+, Ni2+, Cr3+, Sn4+, Pt4+ |
Номенклатура комплексных соединений.В соединении сначала называют анион, а затем катион. При указании состава внутренней сферы прежде всего называют анионы, прибавляя к латинскому названию суффикс —о-,например: Cl– – хлоро, CN– – циано, OH– – гидроксо и т.д.
Далее называют нейтральные лиганды ив первую очередь аммиак и его производные. При этом пользуются терминами: для координированного аммиака – аммин, для воды – аква. Число лигандов указывают греческими словами: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем переходят к названию центрального атома.
Если центральный атом входит в состав катионов, то используют русское название соответствующего элемента и в скобках указывают его степень окисления (римскими цифрами).Если центральный атом содержится в анионе, тоупотребляют латинское название элемента, а в конце прибавляют окончание —ат.
В случае неэлектролитов степень окисления центрального атома не приводят, т.к. она однозначно определяется из условия электронейтральности комплекса.
Примеры. Чтобы назвать комплекс [Cu(NH3)4]Сl2, определяют степень окисления(С.О.)
х комплексообразователя – иона Cuх+:
1•x + 2•(–1) = 0, x = +2,C.O.(Cu) = +2.
Аналогично находят степень окисления иона кобальта:
y + 2•(–1) + (–1) = 0, y = +3,С.О.(Со) = +3.
Чему равно координационное число кобальта в этом соединении? Сколько молекул и ионов окружает центральный ион? Координационное число кобальта равно шести.
Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки. Например:
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди(II),
[Co(NH3)3H2OCl2]NO3 – нитрат дихлороакватриамминкобальта(III),
K3[Fe(CN)6] – гексацианоферрат(III)калия,
K2[PtCl4] – тетрахлороплатинат(II)калия,
[Zn(NH3)4Cl2] – дихлоротетраамминцинк,
H2[SnCl6] – гексахлорооловянная кислота.
На примере нескольких комплексных соединений определим структуру молекул (ион-комплексообразователь, его С.О., координационное число, лиганды, внутреннюю и внешнюю сферы), дадим название комплексу, запишем уравнения электролитической диссоциации.
K4[Fe(CN)6] – гексацианоферрат(II) калия,
K4[Fe(CN)6] 4K+ + [Fe(CN)6]4–.
H[AuCl4] – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
H[AuCl4] H+ + [AuCl4]–.
[Ag(NH3)2]OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
[Ag(NH3)2]OH [Ag(NH3)2]+ + OH–.
Na[Al(OH)4] – тетрагидроксоалюминатнатрия,
Na[Al(OH)4] Na+ + [Al(OH)4]–.
К комплексным соединениям относятся и многие органические вещества, в частности, известные вам продукты взаимодействия аминов с водой и кислотами. Например, соли хлорид метиламмонияи хлорид фениламмония являются комплексными соединениями. Согласно координационной теории они имеют следующее строение:
Здесь атом азота – комплексообразователь, атомы водорода при азоте, радикалы метил и фенил – лиганды. Вместе они образуют внутреннюю сферу. Во внешней сфере находятся хлорид-ионы.
Многие органические вещества, имеющие большое значение в жизнедеятельности организмов, представляют собой комплексные соединения. К ним относятся гемоглобин, хлорофилл,ферменты идр.
Комплексные соединения находят широкое применение:
1) в аналитической химии для определения многих ионов; 2) для разделения некоторых металлов и получения металлов высокой степени чистоты; 3) в качестве красителей; 4) для устранения жесткости воды;
5) в качестве катализаторов важных биохимических процессов.
Источник: https://him.1sept.ru/article.php?id=200500610