Медь как металл и сырье в строительстве: ее особенности и нюансы обработки
В большей части промышленных отраслей используется такой металл, как медь. Благодаря высокой электропроводности без этого материала не обходится ни одна область электротехники.
Из нее образуются проводники, обладающими отличными эксплуатационными особенностями. Помимо этих особенностей медь обладает пластичностью и тугоплавкостью, устойчивостью к коррозии и агрессивным средам.
И сегодня мы рассмотрим металл со всех сторон: укажем цену за 1 кг лома меди, поведаем о ее использовании и производстве.
Медь представляет собой химический элемент, носящийся к первой группы периодической системы имени Менделеева. Этот пластичный металл имеет золотисто – розовый цвет и является одним из трех металлов с ярко выраженным окрашиванием. С давних времен активно используется человеком во многих областях промышленности.
Главной особенностью металла является его высокая электро- и теплопроводность. Если сравнивать с другими металлами, то проведение электрического тока через медь выше в 1,7 раз, чем у алюминия, и почти в 6 раз выше, чем у железа.
Медь имеет ряд отличительных особенностей перед остальными металлами:
- Пластичность. Медь представляет собой мягкий и пластичный металл. Если брать во внимание медную проволоку, она легко гнется, принимает любые положения и при этом не деформируется. Сам же металл достаточно немного надавить, чтобы проверить эту особенность.
- Устойчивость к коррозии. Этот фоточувствительный материал отличается высокой устойчивостью к возникновению коррозии. Если медь на длительный срок оставить во влажной среде, на ее поверхности начнет появляться зеленая пленка, которая и защищает металл от негативного влияния влаги.
- Реакция на повышение температуры. Отличить медь от других металлов можно путем ее нагревания. В процессе медь начнет терять свой цвет, а затем становиться темнее. В результате при нагреве металла он достигнет черного цвета.
Благодаря таким особенностям можно отличить данный материал от латуни, олова, бронзы и других металлов.
ниже расскажет вам про полезные свойства меди:
Преимуществами данного металла являются:
- Высокий показатель теплопроводности;
- Устойчивость к влиянию коррозии;
- Достаточно высокая прочность;
- Высокая пластичность, которая сохраняется до температуры -269 градусов;
- Хорошая электропроводность;
- Возможность легирования с различными добавочными компонентами.
Про характеристики, физические и химические свойства вещества-металла меди и ее сплавов читайте ниже.
Свойства и характеристики
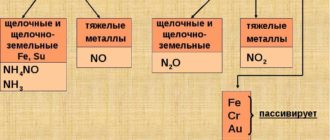
Медь, как малоактивный металл, не вступает во взаимодействие с водой, солями, щелочами, а также со слабой серной кислотой, но при этом подвержена растворению в концентрированной серной и азотной кислоте.
Физические свойства метала:
- Температура плавления меди составляет 1084°C;
- Температура кипения меди составляет 2560°C;
- Плотность 8890 кг/м³;
- Электрическая проводимость 58 МОм/м;
- Теплопроводность 390 м*К.
Механические свойства:
- Предел прочности на разрыв при деформированном состоянии составляет 350-450 МПа, при отожженном – 220-250 МПа;
- Относительное сужение в деформированном состоянии 40-60%, в отожженном – 70-80%;
- Относительное удлинение в деформированном состоянии составляет 5-6 δ ψ%, в отожженном – 45-50 δ ψ%;
- Твердость составляет в деформированном состоянии 90-110 НВ, в отожженном – 35-55 НВ.
При температуре ниже 0°С этот материал обладает более высокой прочностью и пластичностью, чем при +20°С.
Структура и состав
Медь, имеющая высокий коэффициент электропроводности, отличается наименьшим содержанием примесей. Доля их в составе может приравниваться 0,1%. С целью увеличения прочности меди в нее добавляют различные примеси: сурьма, цинк, олово, никель и прочее. В зависимости от ее состава и степени содержания чистой меди различают несколько ее марок.
Структурный тип меди может включать в себя также кристаллы серебра, никеля, кальция, алюминий, золота и других компонентов. Все они отличаются сравнительной мягкостью и пластичностью. Частичка самой меди имеет кубическую форму, атому которой расположены на вершинах F –ячейки. Каждая ячейка состоит из 4 атомов.
О том, где брать медь, смотрите в этом видеоролике:
В природных условиях данный металл содержится в самородной меди и сульфидных рудах. Широкое распространение при производстве меди получили руды под названием «медный блеск» и «медный колчедан», которые содержат до 2% необходимого компонента.
Большую часть (до 90%) первичного металла меди получают благодаря пирометаллургическому способу, который включает в себя массу этапов: процесс обогащения, обжиг, плавка, обработка в конвертере и рафинирование. Оставшаяся часть получается гидрометаллургическим способом, который заключается в ее выщелачивании разведенной серной кислоты.
Медь активно используется в следующих областях:
- Электротехническая промышленность, которая заключается, в первую очередь, в производстве электропроводов. Для этих целей медь должна быть максимально чистой, без посторонних примесей.
- Изготовление филигранных изделий. Медная проволока в отожженном состоянии отличается высокой пластичностью и прочностью. Именно поэтому, она активно используется при производстве различных шнуров, орнаментов и прочих конструкций.
- Переплавка катодной меди в проволоку. Самые разнообразные медные изделия переплавляются в слитки, которые идеально подходят для дальнейшей прокатки.
Медь активно используется в самых различных сферах промышленности. Она может входить в состав не только проволоки, но и оружия и даже бижутерии. Ее свойства и широкая сфера применения благоприятно повлияли на ее популярность.
ниже расскажет о том, как медь может изменить свои свойства:
Источник: http://stroyres.net/metallicheskie/vidyi/tsvetnyie/med/kak-syire-v-stroitelstve.html
Как правильно соединить медный и алюминиевый провод
В старых зданиях часто можно встретить алюминиевую электрическую проводку. Теперь уже всем понятно, что это не лучший металл для тока. Сегодня при капитальном ремонте обычно меняют всю проводку старого здания. Однако при частичном ремонте возникает необходимость соединения алюминиевого и медного проводов.
Можно ли соединять алюминиевые провода с медными
Прежде всего нужно вернуться к школьной программе по химии и физике. Есть такое понятие как «гальванический элемент» – простая батарейка, генерирующая электрический ток. Он образуется путем взаимодействия металлов в электролите. Скручивание медной и алюминиевой проводки кабеля, по сути, будет той же самой батарейкой.
Соединения проводов
Гальванический ток быстро разрушает металл. Несмотря на то, что он не образуются в сухом воздухе, а скрутка в розетке не развалится за день, проблемы при долгой эксплуатации проводки обеспечены.
Спустя несколько месяцев или лет провода начнут разрушаться – это приведёт к росту сопротивления. Когда к розетке подключат мощный потребитель тока, скрутка перегреется. При регулярной эксплуатации такого соединения имеется риск возгорания.
Возгорания проводки
Правила запрещают скручивать алюминиевые и медные проводники напрямую. Однако в экстренных ситуациях переход необходимо сделать, потому нужно следовать определенным правилам.
Что будет при контакте меди и алюминия
Любой металл, в том числе медь и алюминий, окисляются под воздействием кислорода. Это приводит к образованию оксидной пленки на поверхности материала. В случае с медью она не препятствует прохождению электрического тока, но пленка на алюминии повышает его сопротивление.
В случае соединения проводов разнородные металлы начнут плотное взаимодействие. Алюминий считается более активным, потому при скоплении влаги на стыках (она в любом случае присутствует в воздухе) начинается процесс электролиза, то есть ионы алюминия постепенно переносятся на медь.
Скрутка металлов
В итоге один из проводников теряет свою массу. В алюминии образуются пустоты и пробои – они также окисляются, что ускоряет процесс электролиза. Скорость процесса зависит еще и от объема влаги. Ближе к концу реакции получается практически разрушенный алюминиевый проводник – его сечение уменьшается, а плотность тока возрастает. Как уже было описано выше, металл греется и возникает риск возгорания.
Правила соединения медных проводов с алюминиевым
Существуют безопасные способы соединения медных и алюминиевых проводов:
Болтовое соединение
Этот способ считается самым доступным, надежным и простым. Для обустройства понадобится:
- Болт;
- Гайка;
- Стальные шайбы (несколько штук);
- Гаечный ключ.
Вряд ли получится применить этот способ для соединения проводов в квартирной распределительной коробке – сегодня их делают слишком маленькими, а готовый соединительный узел выходит достаточно большим.
Однако, если в строении установлена коробка советских времен или приходится работать в распределительном щитке, то болтовой метод – наилучшее решение.
Его принято считать идеальным решением, если приходится коммутировать полностью несовместимые жилы – с разным сечением, из разных материалов, много/одножильные.
Важно! Болтовой метод позволяет соединить больше 2 проводников (их число зависит от длины болта).
Процесс устройства соединения:
- Каждый из проводов придется зачистить от слоя изоляции – на 2–3 см от края.
- Из очищенных концов собирается кольцо по окружности болта, чтобы они без проблем могли на него надеваться.
- Далее берётся болт, а на него надевается шайба, после чего кольцо медного провода, затем вторая шайба, кольцо алюминиевого проводника, в конце – третья шайба вся полученная конструкция затягивается гайкой.
- В конце необходимо обезопасить соединение, использовав изоляционную ленту. Важно не забывать, чтобы между алюминием и медью находилась промежуточная шайба. Если планируется работать с несколькими разными проводниками, то между жилами одинакового материала шайба не обязательна.
Болтовое соединение
Особым преимуществом этого метода считается универсальность соединения. Его можно раскрутить и заново скрутить в любой момент и, если понадобится добавить провода, либо изменить схему подключения.
Клеммы
Другой дешевый и простой способ соединения – клеммные колодки. Их легко найти и купить, особенно, если учитывать, что часто продаются не целыми секциями, а отрезается в необходимом для работы количестве. Колодки бывают разных размеров, что напрямую зависит от сечения проводников.
Клеммы
Клеммники для соединения алюминиевых и медных проводов представляют собой пластмассовый каркас на несколько ячеек. Внутри каждой находится латунная трубчатая гильза. С разных сторон внутрь клеммы продеваются зачищенные кончики проводов и зажимаются винтами. Обустройство соединения:
- Ослабить зажим, освобождая одну часть гильзы, чтобы продеть в гильзу оголённую часть провода.
- На конце проводника зачистить изоляцию – на 5–6 мм. Провод вставляется в колодку, винт зажимается, фиксируя металл на гильзе. Крепление должно быть закручено прочно, но не сильно, иначе оно перебьет жилу.
- Аналогичные действия для подключения медного провода – только с противоположной стороны клеммы.
Важно! Все этапы работы необходимо проводить последовательно, несмотря на то, что физически можно разжать оба винта, продеть провода и закрутить за раз. Это необходимо, чтобы медь и алюминий не соприкасались концами внутри гильзы.
Основным преимуществом клемм считается простота их устройства и скорость установки. Метод называют разъёмным – один из проводников можно без особых проблем вытащить, чтобы соединить другой.
Клеммы с рычагами
Колодки плохо подходят для работы с многожильными проводами. В таком случае сначала придется монтировать втулочный наконечник, который обжимается пучком жил.
Другая особенность клемм – под давлением винта при комнатной температуре алюминий иногда подтекает. Это приводит к необходимости регулярно проверять колодки и подтягивать контакты. Если этого не делать, контакт слабеет, соединение нагревается и искрит – появляется риск пожара.
Клеммные колодки Wago
Быстрый и простой способ соединения – жилы нужно предварительно зачистить и продеть в клеммы до упора. Там они автоматически фиксируются при помощи прижимной пластины – она сильно придавливает материал к шине. Прозрачный корпус клемм позволяет контролировать проход проводника. Проблема способа – одноразовость таких приспособлений.
Если нужен многоразовый зажим, то лучше купить рычажковые клеммы. Рычаг приподнимается, чтобы освободить проход в отверстие – туда вставляется зачищенный провод. Затем рычаг опускается, чтобы зафиксировать жилу внутри клеммы. Это разъемное соединение меди и алюминия – при необходимости рычаг поднимается, чтобы достать проводник наружу.
Интересно! Большой популярностью и доверием на рынке пользуются самозажимные приспособления «WAGO». Компания выпускает специальную серию клемм, оснащённых контактной пастой «Alu-plus». Это смесь, защищающая контакты алюминия и меди от образования коррозии. Модель можно отличить по специальной маркировке «Al Cu».
Пользоваться самозажимными конструкциями очень просто. На самой клемме указано, на какую длину требуется зачистить изоляцию жилы.
Заклепки
Заклепки используются для обустройства неразъемного соединения, которое обладает теми же преимуществами, что и резьбовое, но не предполагает разборку и повторную сборку без разрушения заклепки и требует специального инструмента – соединителя.
Сегодня метод чаще используют для соединения тонкостенных элементов при формировании перегородок и интерьера разных помещений. Электрики выбирают заклепки из-за их низкой стоимости, прочности и простоты монтажа.
Заклепки
Принцип монтажа электросоединения прост: происходит втягивание и обрезание металлического стержня, продетого через трубчатую заклепку со шляпкой. У стержня предусмотрено утолщение – он расширяет заклепку, когда проходит через трубку. Фиксаторы бывают разной длины и размера.
Перед соединением проводов их нужно подготовить таким же способом, как и в случае с резьбовой связкой. Диаметры колечек должны быть слегка больше диаметров заклепок – оптимальный равен 4 мм. На заклепку сперва надевают алюминиевую жилу, потом пружинную шайбу, дальше медный проводник и вторую шайбу. Стальной стержень продевается в электроустановку и инструмент зажимает до щелчка (так обрезаются стальные излишки). Все готово.
Соединения, как резьбовые, так и неразъемные характеризуются надежностью. Этот методы используется для сращивания, к примеру, поврежденной при ремонтных работах алюминиевой проводки. Обязательно нужно обустроить изоляцию оголенных участков.
Паяльник
Пайка проводов, состоящих из разных металлов – вполне реализуемое решение, если учитывать определенные правила работы. Медь не вызывает трудностей при спаивании, чего не скажешь об алюминии. На его поверхности образуется амальгама, которая характеризуется сильной химической стойкостью – она не обеспечивает припою должной адгезии.
Спаянные провода
Для работы с двумя разнородными металлами проводов придется подготовить раствор медного купороса, батарейку типа «Крона» и отрезок медной проволоки. На алюминиевой жиле аккуратно зачищается будущее место пайки. Потом на это место наносится раствор медного купороса.
Медную проводку соединяют с положительным полюсом батареи «Крона» и погружают в раствор купороса. К отрицательному полюсу подключается алюминиевый проводник. Через некоторое время на алюминии отложится медный слой – на него припой цепляется без проблем.
Переходники для соединения с алюминия на медь
Гильзовые переходники для опрессовки считаются самым надежным и качественным соединением. Изготавливаются специальные медно-алюминиевые модели, в которые заводятся 2 провода, после чего они обрабатываются прессом. Однако нужно отметить, что гильзы предполагают сечения начиная с 16 мм2, тогда как в жилых зданиях используется от 1,5 до 4 мм2. Потому подключение лучше вести с использованием стандартной алюминиевой гильзы. Опрессовка происходит по алгоритму:
- Зачистить концы медного проводника лудим свинцово-оловянным припоем – это помогает предотвратить контакт металлов.
- Избавиться от оксидной пленки алюминия.
- Продеть провода с разных концов и опрессовать.
- Обмотать соединения изолентой или термоусадкой с последующим нагревом.
Важно! При чрезмерном обжиме внутри конструкции спаянный слой на медном конце может повредиться, потому размер гильзы и матрицы должен подходить под жилу.
Переходник с алюминия на медь хорош тем, что его можно заделывать под штукатурку, не опасаясь возгорания проводки. Однако, для реализации потребуется пресс, который влечёт за собой определённые затраты.
Гильзы
Рекомендуется, чтобы при производстве работ вся электропроводка была цельной, без обрывов и соединений – так снижается риск возгорания. Однако, если возникает острая необходимость, состыковать медную и алюминиевую жилу, то нужно учитывать все рекомендации и выбрать один из наиболее оптимальных методов.
Источник: https://rusenergetics.ru/provoda-i-kabeli/kak-soedinit-medniy-i-alyuminieviy
Аналитика
На Лондонской бирже металлов отмечается рост цен на медь по сравнению с предыдущей неделей на 145 $/т, до 6301 $/т. Положительная динамика котировок связана с ростом потребления металла в Китае на фоне заключения торгового соглашения первой фазы между Пекином и Вашингтоном по урегулированию экспортных тарифов.
Отметим, что по данным таможенного союза Китая, импорт меди в декабре вырос на 9,1%, до 527 тыс. тонн по сравнению с предыдущим месяцем и на 22,8% по сравнению с аналогичным периодом прошлого года.
В то же время, по данным Национального бюро статистики Китая, индекс промышленного производства в декабре не изменился и остался на уровне ноября — 50,2%, однако в сравнении с декабрем прошлого года, рост составил 0,8%. В текущих условиях запасы меди на LME по сравнению с прошлой неделей снизились на 7,5%, до 128,05 тыс. тонн.
Фьючерсные котировки меди на Лондонской бирже металлов выросли на 2,3 %, до 6330 $/т. Фьючерсные котировки меди на Шанхайской бирже металлов с поставкой в феврале выросли по сравнению с прошлой неделей на 1,8%, до 7121 $/т.
Переработка меди
В перерабатывающем секторе отмечается положительная динамика. Канадская компания First Quantum сообщила об увеличении производства меди в 2019 году на 15,8%, до 702 тыс. тонн по сравнению с предыдущим годом за счет достижения уровня промышленной выработки концентрата на руднике Cobre Panama. Компания также прогнозирует рост добычи металла в 2020 году на 25%.
Австралийская компания New World Resources сообщила о восстановлении добычи на руднике Antler, США, производительность которого составляла 70 тыс. тонн меди в год (по данным 1975 года). Компания Gécamines (ДР Конго) совместно с китайской CNMC начали добычу меди на месторождении Deziwa, производительность 70 тыс. тонн меди в год.
Отметим, что оцененные запасы металла на месторождении составляют 4,6 млн тонн.
Спотовый рынок меди
На спотовом рынке отмечается положительная динамика. Котировки премий к цене на катодную медь в США выросли по сравнению с прошлой неделей на 11 $/т, до диапазона 167-189 $/т в результате роста цен на ж/д и авто перевозки, а также усиления эффекта контанго на LME. Отметим, что по данным 15 января, спред между фьючерсными и спотовыми котировками на LME находится на отметке 38 $/т.
В Китае котировки премий выросли в результате сокращения предложения металла в канун праздничных выходных. Отметим, что с 24 по 30 января в Китае считаются выходными в честь празднования Нового года. Цены на премии медных катодов выросли по сравнению с прошлой неделей на 2 $/т, до 35-50 $/т CIF. Отметим, что запасы меди на Шанхайской бирже выросли на 6,4%, до 273-282 тыс. тонн по сравнению с данными 13 января.
На европейском рынке отмечается стабилизация котировок из-за низкого сезонного спроса. В то же время, поддержку рынку оказывает положительный спред на LME между спотовыми и фьючерсными ценами (по данным 15 января, контанго составляло 38 $/т). Котировки премий на медь в порту Ливорно остались на уровне 45-55 $/т CIF Ливорно.
Котировки в порту Роттердама не изменились по сравнению с прошлой неделей и остались в диапазоне 40-50 $/т CIF, Роттердам.
Популярное:
Источник: http://www.translom.ru/analytic/obzor-mirovogo-rynka-medi-nedelya-320_193.html
Медь и её характеристики
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск Cu2S; халькопирит, или медный колчедан CuFeS2; малахит (CuOH)2CO3.
Чистая медь – тягучий вязкий металл светло-розового цвета (рис. 1), легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру.
В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая пленка оксидов (придающая меди боле темный цвет) служит хорошей защитой от дальнейшего окисления.
Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3.
Рис. 1. Медь. Внешний вид.
Атомная и молекулярная масса меди
Поскольку в свободном состоянии хром существует в виде одноатомных молекул Cu, значения его атомной и молекулярной масс совпадают. Они равны 63,546.
Изотопы меди
Известно, что в природе медь может находиться в виде двух стабильных изотопов 63Cu (69,1%) и 65Cu (30,9%). Их массовые числа равны 63 и 65 соответственно. Ядро атома изотопа меди 63Cu содержит двадцать девять протонов и тридцать четыре нейтрона, а изотоп 65Cu – столько же протонов и тридцать шесть нейтронов.
Существуют искусственные нестабильные изотопы меди с массовыми числами от 52-х до 80-ти, а также семь изомерных состояний ядер, среди которых наиболее долгоживущим является изотоп 67Cu с периодом полураспада равным 62 часа.
Ионы меди
Электронная формула, демонстрирующая распределение по орбиталям электронов меди выглядит следующим образом:
1s22s22p63s23p63d104s1.
В результате химического взаимодействия медь отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Cu0 -1e → Cu+;
Cu0 -2e → Cu2+.
Молекула и атом меди
В свободном состоянии медь существует в виде одноатомных молекул Cu. Приведем некоторые свойства, характеризующие атом и молекулу меди:
| Энергия ионизации атома, эВ | 7,72 |
| Относительная электроотрицательность | 1,90 |
| Радиус атома, нм | 0,128 |
Сплавы меди
Важнейшими сплавами меди с другими металлами являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних входят другие элементы, например железо, алюминий, олово, кремний.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30% никеля и небольшие количества железа и марганца, а нейзильберы содержат 5-35% никеля и 13-45% цинка. К электротехническим медноникелевым сплавам относятся константан (40% никеля, 1,5% марганца), манганин (3% никеля и 12% марганца) и копель (43% никеля и 0,5% марганца).
Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и т.д.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/med-i-eyo-xarakteristiki/
Свойства меди
Свойства меди, металла, который встречается и в виде довольно больших самородков, люди изучали еще в древности. Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения.
Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности.
В этой статье поговорим о свойствах меди и методах ее определения.
Физические свойства меди
Чистая медь – это металл, цвет которого варьируется от розового до красного оттенка. Радиус положительно заряженных ионов меди, может принимать такие значения:
- при координационном показателе равном 6-ти — до 0,091 нм
- при координационном показателе равном 2 — до 0,06 нм.
Радиус атома меди равняется 0,128 нм. Величина сродства к электрону достигает 1,8 эВ. Процесс ионизации данного атома увеличивает сродство к электрону от 7,726 до 82,7 эВ.Медь является переходным металлом. Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга.
Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м.
Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм.
Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Кроме вышеперечисленных, стоит выделить еще и такие физические и механические свойства меди:
- показатель термического линейного расширения составляет 0,00000017 единиц
- показатель предела прочности на растяжение достигает 22 кгс/мм2
- уровень твердости меди по шкале Бринелля равен 35 кгс/мм2
- удельная масса составляет 8,94 г/см3
- показатель упругости равен 132000 Мн/м2
- относительное удлинение равняется 60%.
Абсолютно неповторимыми можно назвать магнитные свойства этого металла, который является полностью диамагнитным. Именно благодаря этим показателям, вместе с физическими свойствами, к примеру, удельным весом и удельной проводимостью, можно объяснить такую широкую популярность этого металла в производстве изделий электротехнической отрасли.
Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Единственная характеристика меди, которую можно изменить — это предел прочности.
Этот показатель может быть улучшен почти в два раза (до 420–450 МН/м2), путем специальной технологической операции, называемой наклеп.
Химические свойства меди
Химическая характеристика меди определяется ее расположением в периодической таблице элементов Менделеева, где ей присвоен порядковый номер 29. Находится она в четвертом периоде и в одной группе с благородными металлами. Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Если уровень влажный не высокий, то медь почти не проявляет химической активности. Однако, все кардинально меняется, когда изделия помещают в условия высокой влажности и повышенного содержания углекислого газа. Именно такие условия являются идеальными для начала активного окисления меди.
В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения.
Кроме влажности, процесс окисления запускает и нагревание.
В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Медь довольно легко вступает в реакции с элементами, находящимися в группе галогенов. Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Взаимодействие с кислотами:
- результатом реакции с серной кислотой является сульфат и чистая медь
- с бромоводородной и иодоводородной кислотой соответственно образуются бромид и иодид меди.
А вот взаимодействие со щелочами позволяет получить купрат. Реакции получения меди, при которых происходит восстановление металла до свободного состояния, невозможны без присутствия оксида углерода, аммиака, метана и некоторых других веществ.
Основные свойства меди позволяют ей вступать во взаимодействие с раствором солей железа. Результатом такой реакции является восстановление железа. Эту реакцию применяют для снятия ранее напыленного медного слоя с разных изделий.
Свойства солей меди
Одно- и двухвалентная медь может формировать комплексные соединения, которые выделяются высоким уровнем устойчивости. К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.Сульфат меди (II) — CuSO4 в безводном состоянии является белым порошком. При добавлении воды он приобретает синюю окраску.
Поэтому его используют для выявления остатков воды в органических жидкостях. Водный раствор сульфата меди отличается сине-голубым оттенком. За этот цвет отвечают гидратированные ионы [Cu(H2O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
Из водного раствора сульфат меди кристаллизуется с пятью молекулами воды, путем формирования прозрачных синих кристаллов медного купороса. Полученное соединение используется:
- в процессе электролитического нанесения меди на металлы
- для создания минеральных красок
- как исходный материал для получения прочих соединений меди.
В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.Хлорид меди (II) — CuCl2. 2H2O. Это легко растворимое в воде соединение темно-зеленого цвета. Высокая концентрация хлорида меди позволяет получить растворы зеленого цвета, а разбавление приводит к окраске в сине-голубой оттенок.Нитрат меди (II) — Cu(NO3)2.3H2O.
Его получают путем растворения меди в азотной кислоте. В процессе нагревания синие кристаллы нитрата меди сначала отдают воду, после чего с легкостью разлагаются, выделяя кислород и бурый диоксид азота, становясь оксидом меди (II).Гидроксокарбонат меди (II) — (CuOH)2CO3. Данное вещество можно встретить в природе в виде минерала малахита, который отличается красивым изумрудно-зеленым цветом.
В лабораторных условиях его можно создать при помощи действия Na2CO3 на растворы солей меди (II).2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2Кроме этого, его используют, чтобы получить хлорид меди (II), а также приготовить синие и зеленые минеральные краски.
Ацетат меди (II) — Cu (CH3COO)2.H2O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты.
Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Помните, что все без исключения соли меди являются ядовитыми. По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
Методы определения меди
Определение меди может проводиться такими методами:
- химическими
- количественными
- фотометрическими.
Различные химические составы способны оказывать влияние на расщепление молекул и атомов вещества, следовательно, можно выделить его составные части. Химический метод определения количества заключается в электролитическом методе измерения медной части в сплавах других металлов. Его осуществляют при помощи таких элементов:
- ацетилен
- винная кислота
- водный аммиак
- азотнокислый аммоний
- динатриевая соль
- этиловый спирт
- купризон.
Прежде всего, происходит взвешивание медного состава (навески). После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины.
Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.Контрольным испытанием является повторный процесс электролиза. Необходимо электроды погрузить в раствор, ниже уровня выделенной меди и подключить ток. При правильном проведении первой реакции, во время контрольной процедуры вы не увидите налета металла. Полученный таким образом медный катод нужно промыть водой, не отключая электроток, а потом обработать этиловым спиртом и высушить.
После этого катод необходимо взвесить, и сопоставить массу с первоначальным весом. Итак, вы получите удельный вес меди в соединении.Разработано большое количество видов химических растворов для очистки медных изделий.
Количественное определение массы меди в общем объеме металла целесообразно использовать для сплавов с никелем, бронзой или цинком. При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить.
Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
- тетрароданодиаминхромиат аммония, называемый солью Рейнеке
- тиокарбонат калия способен осадить медь при температуре выше 80 оС
- уксусной кислотой можно осадить медный оксалат.
Из органических веществ применяются:
- оксихинолин-8, который способен осадить медь в комплексе с аммиачным и щелочным раствором. Нагревание осадка приводит к образованию оксида меди
- α-бензоиноксим при участии спирта может осадить металл в форме хлопьев. Реакция невозможна, если в составе есть никель
- йодид калия применяют в нейтральной и кислой среде. Нет смысла использовать его, когда в сплаве имеется железо, сурьма и мышьяк.
Достоинства фотометрического метода заключаются в высоком показателе точности измерения количества меди, а также простота применения. Для реализации этого метода потребуются такие соединения:
- купризон
- диэтилдитиокарбамат свинца.
Смысл фотометрического метода определения меди состоит в фиксации интенсивности цвета материала, прошедшего через концентрированный раствор. Раствор состоит из:
- аммиака
- лимоннокислого раствора аммония
- диэтилдитиокарбамата свинца
- сернокислого натрия.
Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Определение меди возможно также и в сточных, канализационных, речных, морских водах, и в составе почве. Существует три способа:
- атомноабсорбционный прямой
- атомноабсорбционный при участии хелатообразования
- атомноабсорбционный, подразумевающий использование графитовой печи.
Чтобы определить количество меди в почве самым надежным методом является метод с использованием графитной печи.
Для этого пробу почвы нужно поместить в графитовую трубу, обезводить при помощи сжигания и распылить. Процедура распыления сопряжена с разделением вещества на атомы, с последующей фильтрацией и выделением из них нужного металла. Чтобы оценить пробу грунта можно воспользоваться любым фотометрическим методом определения меди.
Источник: http://mining-prom.ru/cvetmet/med/svoystva-medi/
Химические и физические свойства меди
1001student.ru > Химия > Химические и физические свойства меди
Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла — Cu (купрум, cuprum); он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль; молекулярная масса — 63,5 а. е. м.
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
- Физические свойства и характеристика
- С чем реагирует
- Отношение к кислороду
- Взаимодействие с водой
- Реакции с кислотами
- Отношение к галогенам и неметаллам
- Реакции с оксидами неметаллов
- Химические свойства меди
- Заключение
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.
Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.
В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Источник: https://1001student.ru/himiya/svojstva-medi.html
Медь — это тело или вещество? Свойства меди
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь — это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес — 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.
Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как «купрум», русское наименование — медь.
Медь — это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями «вещество» и «тело». Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело — это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.
- Сахар — вещество, леденец на палочке — тело.
- Железо — вещество, гвоздь — тело.
- Окно — тело, стекло — вещество.
Очевидно из этих рассуждений, что на вопрос: «Медь — это тело или вещество?» — ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь — это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.
Простое вещество медь — это цветной металл
Как мы уже обозначили, медь — металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь — это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Медь — это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь — это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь — это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов — ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь — это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: «Медь — это вещество или физическое тело, когда речь идет о ее сплавах?» Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
https://www.youtube.com/watch?v=DXupvDLiDGE
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза — сочетание меди и олова.
- Мельхиор — никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан — сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь — это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
Источник: https://FB.ru/article/190552/med---eto-telo-ili-veschestvo-svoystva-medi
Записки программиста
J-антенна, она же J-pole — популярная среди радиолюбителей антенна, типично используемая на УКВ. Недавно я решил сделать J-антенну на диапазон 2 метра, просто потому что я никогда раньше ее не делал. Заодно было решено попробовать новый для меня материал, медные трубы.
Теория
По форме J-антенна действительно непоминает латинскую букву J:
Фактически, J-антенна — это вертикальный диполь с запиткой снизу. Верхняя часть представляет собой полотно антенны длиной λ/2, то есть, диполь. Нижняя часть антенны — это согласующая секция. Она представляет собой двухпроводную линию длиной λ/4.
Коаксиальный кабель подсоединяется к антенне в некоторой точке этой секции, как изображенно на картинке.
Этим обеспечивается согласование коаксиального кабеля, имеющего волновое сопротивлением 50 Ом, и диполя, который при запитке с краю имеет высокое сопротивление, несколько тысяч Ом.
Почему такая схема вообще что-то согласует? Чтобы ответить на этот вопрос, рассмотрим два граничных случая. Допустим, мы решили запитать J-антенну в самом низу согласующей секции.
Спрашивается, каково входное сопротивление антенны в этой точке? Нетрудно догадаться, что здесь мы имеем короткое замыкание, то есть, сопротивление 0 Ом. Хорошо, теперь переместимся на λ/4 выше и попытаемся запитать антенну здесь.
Какое мы увидим входное сопротивление? Оказывается, что бесконечно большое, поскольку λ/4 секция является не чем иным, как четвертьволновым трансформатором, на конце которого 0 Ом.
Интуиция подсказывает, что где-то между этими двумя крайностями можно найти любое активное сопротивление, хоть 50 Ом, хоть 75 Ом, хоть любое другое. И действительно, на практике именно так и оказывается.
Практика
Антенну было решено делать из медных труб диаметром 10 мм. Раньше я никогда не паял медные трубы. Как оказалось, это не так уж и трудно:
Понадобятся следующие инструменты: тиски, балон с газом, газовая горелка, паяльная паста для медных труб, перчатки типа садовых, круглый напильник. Опционально — безсвинцовый припой, труборез. Трубы легко режутся, поэтому, если трубореза нет, сойдет ножовка, дремель или что-то такое. Сантехники используют только безсвинцовый припой, потому что свинец токсичен. Но мы не собираемся качать воду через трубы, поэтому сойдет и старый-добрый ПОС-61.
Материалы в антенне были использованы следующие: разъем SO-239, немного толстой медной проволоки, медная труба диаметром 10 мм (минимум 2 метра, лучше с запасом), к ней два уголка под 90° и две муфты, а также немного эпоксидного клея.
Паяка осуществляется следующим образом. На место пайки наносится паяльная паста, одевается соответствующий фитинг — уголок или муфта. Разогреваем газовой горелкой до тех пор, пока паста не станет характерного серебристого цвета.
Это значит, что достигнута оптимальная температура. Отводим горелку в сторону и тыкаем в место пайки немного припоя. Он должен тут же растечься. Выключаем горелку и ждем, пока медь остынет.
На словах скорее всего не очень наглядно, но на вы найдете много видео про то, как это делается.
Важно! Будьте предельно осторожны с газовой горелкой. Температура горения газа в ней — порядка 1000°C.
Размеры антенны не очень критичны. В нашем случае длина волны λ равна:
>>> 300_000_000/145_000_000
2.0689655172413794
Я брал ровно 2 метра. Расстояние между проводниками в согласующей секции — порядка 1-3% от λ. Я использовал в нижней части антенны кусочек трубы длиной 4 см. После припаивания уголков общее расстояние получилось 6 см:
Муфты припаиваются к разъему SO-239 как на фото и одеваются на трубы. Чтобы муфты скользили по трубам, их требуется изнутри немного обработать напильником. Несем антенну на будущее место постоянной установки. Лично я расположил ее на балконе, прикрепив нейлоновыми стяжками к трубе ПВХ. Затем согласуем антенну путем перемещения муфт по согласующей секции.
В моем случае анализатор EU1KY показал идеальное согласование:
Заходим на локальный репитер и убеждаемся, что корреспонденты нас прекрасно принимают. Остается только запаять муфты в таком положении, заклеить оставшиеся отверстия в трубах эпоксидкой, добавить отсекающий дроссель, и антенна готова!