Алюминий — крылатый металл
Алюминий (лат. Аluminium, химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815) — мягкий, легкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C.
По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. В природе представлен лишь одним стабильным нуклидом 27Al.
Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26Al имеет период полураспада 720 тысяч лет.
Алюминий в природе
Алюминий — наиболее распространенный металл на земле, а по распространенности всех элементов в земной коре он занимает третье место. На его долю приходится 8% состава земной коры. Бокситная руда в настоящее время является главным сырьем для получения алюминия.
Ежегодно в мире добывают от 80 до 90 млн. тонн бокситной руды. Почти 30% этого колличества добывают в Австралии и еще 15% на Ямайка. При нынешнем уровне мирового производства алюминия разведанных на земле запасов бокситов достаточно, чтобы обеспечивать потребности в алюминии еще несколько сотен лет.
Применение алюминия
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов, автомобилей.
В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности — для изготовления оконных рам и дверей, а в пищевой промышленности — для изготовления упаковочных материалов.
В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
Биологическое действие металла
Удивительно, но несмотря на широчайшую распространенность алюминия в природе, этот металл практически не встроен в биологические цепочки живых существ. Более того, соединения алюминия оказываютслабое токсическое воздействие на живые организмы.
Солю алюминия, например хлориды, нитраты, вредны для тканей организма человека, поэтому в последнее время люди стали отказыватьсяот использования алюминиевой посуды.
Алюминий способен накапливаться в человеческом организме, поэтому следует избегать излишних контактов с крылатым металлом.
Источник: https://www.allmetals.ru/metals/aluminium/
Особенности металла алюминия: его свойства, преимущества и характеристики
Алюминий — это самый распространенный металл в земной коре, который встречается в виде изотопа. Его активная добыча связана с широкой сферой применения. Благодаря низкой теплопроводности, устойчивости к воздействию коррозии, большой тугоплавкости и жароустойчивости без этого металла не обходится ни одна сфера производства.
Сам металл обладает белым цветом и химической активностью. Вступая в реакцию с воздухом, на его поверхности образуется оксидная пленка, которая защищает его от воздействия влаги и прочих негативных факторов, выступающих в роли раздражителей. Такая реакция не только выступает преимуществом металла, но и в некотором роде является недостатком, корректируя процесс литья.
Производство алюминия должно проходить без доступа воздуха, в противном случае вместо чистого металла будет образовываться смесь алюминия и его оксидов.
Далее рассмотрены преимущества и недостатки эматалирования, анодированного и других видов алюминия, а также его классификация.
Данное видео ознакомит вас с особенностями алюминия:
Благодаря своей структуре и характеристикам, алюминий обладает следующими преимуществами:
- Небольшая масса;
- Устойчивость к коррозии;
- Высокий коэффициент поглощения звука;
- Экологическая безопасность;
- Устойчивость к температурным перепадам;
- Долговечность;
- Возможность корректировки характеристик благодаря примесям.
Что касается недостатков, то можно отметить лишь высокую стоимость, по сравнению с другими металлами. Однако преимущества эту особенность делают менее значимой.
Классификация
Алюминий достаточно редко используется именно в чистом виде, чтобы получить необходимые функции и технические характеристики, в металл добавляются специальные примеси. Если предел прочности чистого металла составляет 90 МПа, то при добавке легирующих компонентов (магний, цинк и прочее) этот показатель можно увеличить до 700 МПа.
Такие алюминиевые сплавы можно разделить на две группы:
- Деформируемые сплавы. Для их производства металл разливается изначально в специальные слитки, которые затем обрабатываются под высоким давлением одним из методов.
- Литейные сплавы. Они отличаются повышенным содержанием кремния и необходимостью литья уже в готовые формы.
Про температуру плавления и кипения алюминия, иные химические свойства и характеристики металла поговорим ниже.
Свойства и характеристики
Физические свойства данного металла зависят напрямую от его чистоты. Если состав алюминия максимально приближен к единице, то в результате достигаются максимально возможные свойства. Именно поэтому он идеально подходит для ковки, штамповки и другим методам обработки.
Отличительной чертой алюминия является возможность применения разных типов сварки. Кроме этого металл обладает следующими характеристиками:
- Низкий коэффициент плотности, который составляет 2,7 г/см³. От этого показателя зависит также его прочность, которая также невелика. Именно по этой причине алюминий в чистом виде не используется в конструкционных целях.
- Высокий коэффициент теплопроводности. Чистый металл при температуре 200°C обладает теплопроводностью в 209 Вт/(м*К).
- Температура плавления у алюминия технического типа составляет 657 °C, а у чистого — 660 °C.
- Удельная теплоемкость составляет 880 Дж/кг·K.
- Температура кипения — 2500 °C.
Далее рассмотрены структура и химический состав алюминия.
Структура и состав
Структура алюминия представлена кубической решеткой из кристаллов. Минимальное расстояние между двумя атомами составляет от 2,863Å. Кристаллическая решетка имеет стабильность при температурных условиях от 4К до непосредственной температуры плавления. Наличие примесей практически не влияет на структуру алюминия.
Помимо чистого алюминия в состав могут входить примеси из цинка, кремния, магния и других металлов. Далее мы рассмотрим получение и применение алюминия на основе его химических и физических свойств.
О том, как правильно расплавить алюминий при помощи газовой плиты, расскажет видеоролик ниже:
Технологический процесс получения данного металла включает в себя три этапа:
- Получение глинозема из первичного сырья (содержащие алюминий руды).
- Создание из получившегося глинозема технического алюминия.
- Процесс максимальной очистки металла.
Получение оксида алюминия происходит из глинозема под действием электролиза. Соединение должно быть максимально чистым, поскольку на этом этапе его получения весьма проблематично избавиться от ненужных примесей.
Чтобы получить алюминий с чистотой приближенной к единице, необходимо организовать несколько цехов для его обработки, каждый из которых будет отвечать за определенный этап производства. Именно поэтому чистый металл имеет достаточно высокую цену, которая достигает до 1700 долларов за 1 т (1000 кг алюминия).
Технические характеристики и возможность подвергать алюминий различным обработкам обусловили его широкое распространение. В частности металл активно используется в следующих областях:
- Авиастроение;
- Автомобилестроение;
- Ракетостроение;
- Производство посуды;
- Пищевая промышленность;
- Судостроение;
- Микроэлектроника;
- Энергетика и многое другое.
Нередко в процессе использования алюминия применяют в симбиозе с другими металлами, например, железом, титаном, никелем, бронзой, медью и т.п. Особенности алюминия, его технические характеристики и широкое распространение сделали этот металл крайне востребованным. Ни она современная область промышленности не обходится без его применения.
Как паять алюминий без специального флюса, поведает этот видеосюжет:
Источник: http://stroyres.net/metallicheskie/vidyi/tsvetnyie/alyuminiy/osobennosti-preimushhestva-i-harakteristiki.html
Аналог бриллианта: название похожего камня и его свойства, способы отличить от натурального
Бриллианты являются самыми дорогими драгоценными камнями. Украшение с сияющим кристаллом может стоить несколько тысяч долларов. Не каждый может позволить себе купить такую драгоценность, поэтому в ювелирном производстве алмазы нередко заменяют другими натуральными и искусственными минералами. К сожалению, этим нередко промышляют мошенники, выдавая за дорогой бриллиант дешевую подделку. Какие бывают имитации алмазов и как отличить оригинал от аналога?
Аналоги бриллианта, их названия, свойства и внешний вид
Бриллиант — уникальный по своим свойствам камень. Он считается самым твердым материалом земной коры. Благодаря огранке луч света внутри кристалла преломляется и придает камню удивительное сияние. В мире не существует минералов, обладающих такими же характеристиками, человеку до настоящего времени не удалось воссоздать алмазы в лабораторных условиях. Однако есть несколько минералов, которые используют в качестве заменителей.
Натуральные камни
В земной коре присутствует немало минералов, похожих на алмазы. Натуральные заменители бриллиантов, которые применяются в ювелирном деле:
- Горный хрусталь — бесцветный, прозрачный диоксид кремния, разновидность кварца. Часто встречается в земной коре, поэтому ювелирные изделия с ним стоят недорого.
- Белые сапфиры — разновидность корунда, лишенная примесей, поэтому вместо привычного синего цвета камень является прозрачным. По своей твердости сапфир приближен к бриллианту. По шкале Мооса твердость алмаза равна 10, а белого сапфира — 9.
- Бесцветный топаз — минерал из группы силикатов алюминия. Больше известны цветные разновидности топаза — золотистые, голубые, розовые. Прозрачный минерал пользуется небольшим спросом, однако может использоваться как замена бриллиантам.
- Циркон — минерал, ортосиликат циркония. Прозрачная разновидность лишена примесей, обладает сильным алмазным блеском, что позволяет использовать камень в качестве заменителя.
- Гошенит — прозрачная разновидность берилла. Зеленые бериллы называются изумрудами. Гошенит стоит недорого, но также применяется для изготовления ювелирных украшений.
Гошенит
Искусственные бриллианты
В химических лабораториях научились создавать синтетические минералы, обладающие нужными свойствами. Названия заменителей:
- Фианит — синтетический диоксид циркония. Его показатель преломления приближен к алмазу, поэтому кристалл часто используют для имитации разных драгоценных камней. На глаз почти невозможно отличить фианит от бриллианта.
- Карборунд — химическое соединение, которое производят путем спекания кремнезема с углеродом при высоких температурах. Твердость приближена к алмазной — 9,5.
Карборунд
Области применения аналогов бриллианта
Созданные природой и руками человека имитации алмазов используются в ювелирном деле для замены драгоценных камней. Однако благодаря своим физико-химическим свойствам эти минералы нашли широкое применение в промышленности и могут заменить сверхтвердые кристаллы алмазов в различных сферах производства.
В таблице представлены сферы применения аналогов бриллиантов кроме ювелирного дела:
| Название минерала | Происхождение | Сфера применения |
| Горный хрусталь | Естественное | Радиотехника, изготовление призм, спектрографов, линз |
| Белый сапфир, лейкосапфир | Естественное, искусственное | Изготовление хрусталиков глаза, брекетов в стоматологии, производство высокопрочных стекол для иллюминаторов, экранов гаджетов |
| Циркон | Естественное | Производство зубных коронок, виниров |
| Фианит | Искусственное | Керамическое напыление в стоматологии |
| Карборунд | Искусственное | Производство абразивов, электронных приборов, астрономической оптики, стали, нагревательных элементов, использование в ядерной энергетике |
Горный хрусталь
Как отличить оригинал от аналога?
Отличить заменитель от природного алмаза сложно. Ювелиры стараются сделать имитацию настолько искусной, чтобы она ничем не отличалась от бриллианта.
В первую очередь при покупке следует спросить сертификат качества на изделие, там должно быть указано, из какого материала сделано украшение. Одно из основных отличий — это твердость кристалла. Если провести по стеклу натуральным бриллиантом, то появится глубокая царапина. Фианит, топаз, горный хрусталь и другие минералы оставят лишь небольшой след.
Циркон
Чтобы узнать наверняка, какой камень вставлен в ювелирное изделие, потребуется помощь ювелиров, геммологов или минералогов. С помощью профессиональных инструментов и химических реактивов специалист сможет определить, что за минерал перед ним.
Источник: https://moykamen.com/galereya/analog-brillianta.html
Алюминий — самый распространенный металл в земной коре
- Алюминий — один из самых распространенных элементов в природе, больше только кислорода и кремния, а среди металлов он занимает первое место по распространенности. Его настолько много, что специалисты оценивают его массовую долю в земной коре до 8%. Как химический элемент, алюминий входит в огромное количество минералов, например, он есть в сапфирах и рубинах, в граните и полевом шпате, в изумрудах и конечно, в бокситах — алюминиевой руде.
Свойства алюминия
Из основных физических свойств алюминия следует особо отметить:— очень небольшую плотность, втрое меньшую плотности стали, цинка и меди (алюминий — легкий металл);— высокую электропроводность, в величине которой уступает лишь меди и серебру;— высокую теплопроводность;— устойчивость к коррозии;— высокую пластичность (мягкий металл);— светоотражающую способность;— парамагнетизм;— возможность образовывать сплавы с другими металлами;— сохранение пластичности и повышение прочности при очень низких температурах;— нетоксичность.
Алюминий легко обрабатывается механическими способами, его можно подвергать холодной и горячей обработке, прокатывать в тончайшую фольгу и проволоку, превращать в порошок.В чистом виде алюминий очень активный металл, который вступает в химическую реакцию с кислотами и щелочами, кислородом, углеродом, азотом, галогенами, водой и другими веществами.
Как ни парадоксально, но выдающаяся устойчивость алюминия к коррозии основана на химической активности металла. На воздухе алюминий тут же покрывается пленкой Аl2О3, которая в нормальных условиях надежно защищает металл от любых дальнейших реакций. Поэтому в самородном виде алюминий практически не встречается, только в виде соединений.
10 интересных фактов о металлах и их удивительные свойства
Металлы – группа химических элементов в виде простых веществ. Все они обладают своими собственными свойствами, по которым их можно разделить на разные группы.
Само слово «металл» пришло в русский язык из Германии. Сначала оно означало то же самое, что и «минерал, руда». Начали разделять понятия уже только после трудов Ломоносова.
Слово замечательно влилось в язык, сейчас его знает каждый. Самыми известными из металлов, наверное, являются золото, серебро, ртуть, медь и железо. Только знания даже о них весьма не полны. Природа всегда находит, чем нас удивить.
В этой статье мы рассмотрим 10 интересных фактов о металлах.
10. Титан используют в качестве импланта
Имплантация – способ восстановления утерянных зубов. Сейчас этот метод очень распространен благодаря своей быстроте и доступности. Он заключается в следующем: в челюсть вживляют стержень, который становится опорой для нового зуба.
Этот самый стержень и делают из титана.
Как металл он обладает высокой прочностью, а по упругости похож на кость человека, поэтому вживление проходит проще. Титан – это самая основа зубного импланта, которая уменьшает риск разрушения кости.
9. Серебро имеет бактерицидные свойства
Серебро было известно людям еще до нашей эры. Какое-то время оно даже ценилось выше золота. Однако о его разных свойствах люди узнают до сих пор.
Например, о непосредственном влиянии ионного серебра на бактерии все еще ведутся споры. Доказано, что при соприкосновении бактерий и ионов, первые погибают в результате воздействия.
Было выдвинуто уже множество теорий, однако точно все еще неизвестны причины гибели микроорганизмов под воздействием серебра.
Ионы этого металла хорошо справляются с возбудителями тифа, протеи, дифтерии и других. Там, где серебро не уничтожает бактерии, оно может замедлить процесс прорастания новых спор и распространения микроорганизмов.
8. Тантал широко используется в протезировании
Тантал – это необычный металл, который довольно редко встречается в чистом виде. По этой причине стал очень дорогим.
Его сложно получить, поэтому его назвали так же, как и героя греческих мифов. Там Тантал постоянно старался получить хотя бы немного еды и воды, но ему все никак не удавалось.
Химик, пытающийся получить этот метал в чистом виде, сравнивал свои труды с танталовыми муками. Несмотря на это, сейчас танталу нашли применение во многих сферах.
Очень широко он распространён в медицине, потому что человеческое тело его не отторгает. Из него производят пластины для черепов, скрепки для соединения сосудов, нити для замен сухожилий и сшивания волокон. Иногда используют для изготовления глазных протезов.
7. Алюминий входит в состав земной коры
Сразу же после своего обнаружения алюминий очень ценился из-за своей схожести с серебром. Да и добыча его в чистом виде была непростой.
Уже сейчас ученые доказали, что этот метал широко распространён везде. Земная кора почти на 8% состоит из него.
Если сравнивать металлы по количеству их содержания в земной коре, он уступает только кислороду и кремнию. Но вот интересный факт, несмотря на его распространенность, алюминий невозможно встретить в природе в свободном виде.
6. Ртуть испаряется в воздухе
Когда люди впервые открыли ртуть, ей было дано название «живое серебро». Это очень точное определение того, как выглядит ртуть.
Редкий металл является жидкостью, но при этом очень тяжелой. Самый распространенный предмет, где можно увидеть ртуть – старый градусник. Все родители запрещают своим детям его трогать. А все из-за свойств ртути, которая может испаряться в воздухе.
Пары, образовывающиеся при испарении, очень токсичны и могут навредить организму человека. Они проникают внутрь, нарушают состав и структуру белков, из-за чего некоторые процессы начинают течь в обратном направлении, что влечет за собой отравление и смерть.
Но летальный исход вызывают только большие количества этого металла, больше чем в обычном градуснике. Однако меры по устранению проблемы в любом случае надо принять незамедлительно.
5. Олово – самый легкоплавкий металл
Вот какой металл уже открыл почти все свои тайны людям, так это олово. Оно стало известно человечеству уже давно.
До открытия свойств железа из сплава олова и меди делали практически все: начиная от оружия, заканчивая украшениями. И это объяснимо.
Олово – один из самых легкоплавких металлов. Температура его — 232 – 240 градусов по Цельсию. Таким образом, надо соблюсти только одно требование – для форм не должен плавиться при температуре до 250 градусов. На этом всё, больше ограничений для плавки, литья, пайки и другого использования у данного металла нет.
4. Иридий – самый плотный металл
Иридий – интересный металл. Он встречается в земной коре еще реже, чем золото и платина. Есть предположение, что его количество намного больше, но располагается оно ближе к ядру Земли, вне досягаемости.
Относительно земной коры, иридий часто встречается в метеоритах. Это самый плотный и тугоплавкий металл. Температура его плавления – 2466 градуса по Цельсию.
По плотности он сравним разве что с осмием. Они практически равны, а разница в числах может быть списана на погрешность.
3. Компания «Valcambi» выпускает слитки из дорогих металлов в форме шоколадных плиток
Компания «Valcambi» – организация в Швейцарии, которая весьма творчески подошла к такому понятию, как слитки.
Когда произносят словосочетание «слитки золота», люди всегда представляют красивые блестящие кирпичики, сложенные пирамидкой друг на друга. Но компания решила разрушить такое представление.
Они делают слитки из золота, серебра, платины и палладия в форме шоколадных плиток. Это стало замечательным решением для подарка.
Такой слиток можно наломать на несколько маленьких частей (примерно 1 грамм) и подарить близким и родным. Другой вариант использования – оплачивать покупки в магазинах, где принимают такой вид оплаты, конечно.
2. Медали олимпийцев вовсе не золотые
Золотые медали олимпийцев серебряные. На самом деле Международный Олимпийский комитет объявил, что золотые спортивные награды должны быть покрытыми всего 6 граммами золота.
Остальной состав медалей может быть серебром. Так, например, если изучать медаль с Олимпийских игр в Лондоне в 2012 году, то результаты исследований будут довольно удивительным. золота в золотой медали составляет всего 1%, хотя все условия соблюдены.
1. В Африке найдено более 50% золота в мире
Все то время что существует человечество, люди тянулись к золоту. Найти жилу – означало несметные богатства. Ради него лгали, воровали, убивали. Но используя все возможные нам методы, за всю историю было найдено около 161 тысячи его тонн.
Больше всего этого дорогого металла обнаружили в ЮАР. Но на самом деле это не так много, как может показаться в самом начале. Легче представить данный факт по-другому.
Если переплавить все найденное золото мира в один большой куб, его сторона составит всего 20 метров. Половина этого куба была найдена в Африке. Примерно каждый час люди достают из земли куб железа таких же размеров. А стоит все золото мира примерно 9 триллионов долларов.
Источник: https://top10a.ru/interesnye-fakty-o-metallax.html
Алюминий в природе (7,5% в земной коре)
Около 1807 г. Дэви, пытавшийся осуществить электролиз глинозема, дал название предполагаемому в нем металлу алюмиум (Alumium).
Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. В 1827 г.
Велер выделил металлический алюминий более эффективным способом – нагреванием безводного хлористого алюминия с металлическим калием.
Нахождение в природе, получение:
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. алюминия в земной коре по данным различных исследователей составляет от 7,45% до 8,14% от массы земной коры. В природе алюминий встречается только в соединениях (минералах).
Корунд: Al2O3 – относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы – сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях.
Бокситы: Al2O3*nH2O – осадочные алюминиевые руды. Содержат вредную примесь – SiO2.
Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов.
Каолинит: Al2O3*2SiO2*2H2O – минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF3 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке. Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии.
Физические свойства:
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см3, температура плавления 660°C, температура кипения 2500°C. Высокая пластичность, прокатывается в тонкий лист и даже фольгу. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. Алюминий образует сплавы почти со всеми металлами.
Химические свойства:
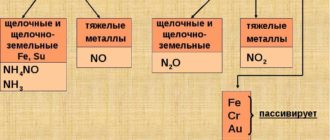
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Однако, при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами: кислородом, галогенами: 2Al + 3Br2 = 2AlBr3 С другими неметаллами алюминий реагирует при нагревании:
2Al + 3S = Al2S3 2Al + N2 = 2AlN
Алюминий способен только растворять водород, но не вступает с ним в реакцию. Со сложными веществами: алюминий реагирует со щелочами (с образованием тетрагидроксоалюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Легко растворяется в разбавленной и концентрированной серной кислотах:
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Алюминий восстанавливает металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Важнейшие соединения:
Оксид алюминия, Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный – более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О Al2O3 + 2NаОН(конц.
) + 3Н2О = 2Na[Al(OH)4](в расплаве щелочи образуется NaAlO2).
Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства. При сплавлении с NaOH образуется NaAlO2.
Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака – при комнатной температуре образуется Аl(ОН)3
Соли алюминия.
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк: Al3+ + H2O =AlOH2+ + H+Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия – квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый – наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным.
Бинарные соединения алюминия Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Применение:
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве – лёгкость, податливость штамповке, коррозионная стойкость, высокая теплопроводность. Алюминий является важным компонентом многих сплавов (медные – алюминиевые бронзы, магниевые и др.) Применяется в электротехнике для изготовления проводов, их экранирования.
Алюминий широко используется и в тепловом оборудовании и в криогенной технике. Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал. Алюминий и его соединения используются в ракетной технике в качестве ракетного горючего.
В производстве строительных материалов как газообразующий агент.
Источник: https://storm24.media/news/44713