К какой группе металлов сплавов относится магний
Магниевые сплавы применяются в промышленности намного чаще, чем чистый магний. Данный металл – легкий и ковкий, серебристо-белого цвета. Он обладает очень высокой химической активностью. На воздухе обычно покрыт тонкой и прочной пленкой окисла, которая препятствует дальнейшему окислению. В присутствии кислой среды или просто высокой влажности пленка разрушается, в результате чего металл начинает активно взаимодействовать с окружающей средой.
Магниевые сплавы
Важная характеристика металла – взаимодействие с кислородом. При высокой температуре магний окисляется кислородом воздуха, сгорая с выделением большого количества тепла и света. Данное свойство послужило широкому применению магния в фотовспышках на заре развития фотографии. Химическая активность и не самые лучшие механические характеристики существенно ограничивают применение чистого магния в промышленности.
Для повышения механических характеристик и придания химической стойкости применяют различные сплавы с магнием. В качестве основных элементов в композициях наибольшее распространение получили алюминий, цинк и марганец. Данные металлы вводятся в состав в количестве до 10%. Кроме этих основных элементов, сюда также входят добавки редкоземельных металлов.
Варьируя химический состав, процентное содержание основных и дополнительных компонентов, можно получить сплавы магния с различными механическими характеристиками, существенно расширяющими область применения и даже позволяющими вытеснить из некоторых областей традиционные материалы – чугун, сталь, алюминий.
Свойства магниевых сплавов зависят не только от состава легирующих добавок, но и от способа дальнейшей обработки.
Влияние легирующих добавок
Металлы в составе композиций улучшают и изменяют физические и химические свойства основного металла. Основной упор делается на повышении механических характеристик. Алюминий улучшает общую структуру, литейные свойства, повышает прочность. Цинк также повышает прочность и способствует уменьшению зерен в отливке. Основная цель введения марганца, кроме увеличения прочности – повышение химической стойкости к воздействию агрессивных сред и снижение вредного влияния примеси железа.
Редкоземельные металлы, несмотря на малое количество, сильно меняют химические и физические свойства, повышая жаропрочность, улучшая пластичность, ковкость за счет уменьшения зерен и изменений в кристаллической решетке.
Добавка циркония уменьшает растворимость водорода в расплаве, которая в чистом составе составляет значительную величину. Связывая водород, цирконий также способствует уменьшению пористости и зернистости отливок.
Введение лития в некоторые составы позволяет получить магниевые сплавы с рекордно малой плотностью – в 2 раза меньшей, чем у алюминия, с сохранением высокой прочности и легкости механической обработки. Данные сплавы наиболее широко используются в аэрокосмической промышленности, где снижение общего веса конструкции увеличивает массу полезной нагрузки.
Внешний вид сплавов магния
Некоторые металлы, напротив, нежелательны даже в малых количествах. Так, примеси железа или никеля даже в объеме тысячных долей процента резко снижают коррозионную стойкость сплава. Растворенный водород увеличивает пористость материала, вызывает увеличение зерен, снижая, таким образом, прочность изделия.
Основные разновидности сплавов магния
Магниевые сплавы различаются технологией изготовления. В соответствии с этим, для всех составов с магнием принята следующая классификация:
- литейные сплавы магния, которые отличаются высокими литейными свойствами;
- деформируемые сплавы, легко поддающиеся механической обработке ковкой прессовкой
Химический состав добавок подобран таким образом, чтобы минимизировать последующую обработку литейных сплавов и увеличить способность к обработке у деформируемых.
Внутри каждой из групп материалы разделяются по своим свойствам, способу литья, методам обработки (прессование, ковка, штамповка и прокат).
Каждая из двух перечисленных групп включает в себя составы с различной прочностью, жаростойкостью, химической стойкостью, а также с различной способностью к свариванию.
Маркировка и свойства
Отечественная промышленность маркирует магниевые сплавы на основе двухбуквенной маркировки с дополнительными цифрами:
- литейные — МЛ1 – МЛ20;
- деформируемые — МА1 – МА19;
- жаропрочные магниевые сплавы ВМЛ1 – ВМЛ2.
Литейные сплавы производятся в большинстве на основе системы Mg – Al – Zn, которая представляет собой твердый раствор алюминия и цинка в магнии. Наилучшими литейными свойствами обладают такие виды растворов, как марки МЛ4 – МЛ6. Данные сплавы обладают высокой текучестью, малой усадкой и не склонны к образованию раковин. Такие характеристики позволяют применять указанные марки при точном литье заготовок любых форм и габаритов.
Жаропрочные сплавы, к которым относятся также марки МЛ9 – МЛ14, способны длительное время выдерживать температуру до 350 ˚С и кратковременно до 400 ˚С. В основе состава система Mg – Zn с добавкой циркония. Кроме жаропрочности, данные сплавы хорошо выдерживают статические и усталостные нагрузки.
Дополнительное легирование редкоземельными металлами в некоторых рецептурах способно уменьшить вероятность трещинообразования, что повышает сопротивляемость деформирующим нагрузкам.
Деформированные сплавы производят на основе систем Mg – Al, Mg – Zn, Mg – Mn. Алюминий и цинк способствуют повышению пластичности и позволяют производить с отливками такие действия давлением, как ковка, прессовка, штамповка, а также холодная и горячая прокатка.
Как и литейные, деформируемые дополнительно легируют редкоземельными металлами, однако здесь нашли также и другие материалы. К ним можно отнести кадмий и серебро, которые повышают прочность при одновременном увеличении пластичности.
Марки МА11 — МА12 деформируемых магниевых сплавов относятся к жаростойким материалам, как и аналогичные литейные.
Сплавы МА14 и МА19 характерны тем, что не допускают применение сварки при дальнейшем применении, в отличие от большинства остальных составов.
Получение и производство
Для изготовления сплавов используются материалы высокой чистоты, поскольку, как говорилось выше, даже мельчайшие примеси нежелательных элементов могу существенно ухудшить свойства готового продукта.
Получение сплавов магния облегчается тем, что температура плавления расплава не превосходит 700˚С. Для получения материала с требуемыми свойствами в расплав чистого магния вводят необходимое количество легирующих элементов. Газовый состав атмосферы вокруг расплава должен быть очищен от водорода, поскольку его высокая растворимость в магнии способна привести к дефектам внутренней структуры.
Обработка отливок
Повысить механические свойства отливок на основе магния можно, применяя несколько методик:
- гомогенизация (закалка);
- закалка со старением для стабилизации свойств;
- рекристализационный отжиг для снятия механических напряжений после обработки давлением;
- диффузионный отжиг для выравнивания внутренней структуры и химического состава в зернах металла.
Отливки из алюминиево-магниевого сплава
Следует заметить, что у большинства сплавов после термической обработки механическая прочность не повышается.
Применение
Применение магниевых сплавов в промышленности и технике связано с высокими техническими характеристиками в качестве замены стальных и алюминиевых деталей с учетом требуемых механических свойств.
Плотность магниевого сплава ниже, чем у алюминия, соответственно, вес детали получается меньше.
Наиболее широкое использование магниевые сплавы получили в авиации, в основном, благодаря легкости (на 20-30% легче алюминия) и высокой прочности. Магний используется для изготовления деталей шасси – стоек, дисков колес, а также различных конструктивных элементов конструкции. Корпуса приборов и механизмов также выполнены из данного материала.
Детали из сплавов магния
Легкий магниевый сплав в конструкции летательных аппаратов позволяет увеличить вес полезной нагрузки, не снижая прочностных характеристик. Такие особенности магниевого сплава обуславливают его широкое распространение в ракетной и космической технике.
Немалая доля конструкционных материалов из сплавов магния используется в автомобильной промышленности. В основном это детали двигателя (картер, поддон), трансмиссии и иные конструктивные элементы. Подсчитано, что при общем весе магниевых сплавов 100 кг, замена деталей на стальные, увеличит массу конструкции на 450 кг.
Шлифовальный станок по металлу своими руками
Из магния изготавливают диски колес. И, хотя они имеют значительно более высокую стоимость, чем традиционные, выигрыш от уменьшения неподрессоренной массе ходовой части автомобиля заметно улучшает динамический характеристики, облегчает работу подвески, делая вождение автомобиля комфортнее и безопаснее.
, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник: http://ooo-asteko.ru/k-kakoy-gruppe-metallov-splavov-otnositsya-magniy/
Магний и его сплавы
Магний —металл серебристо-белого цвета; удельный вес 1,74; температура плавления 650°; магний кристаллизуется в гексагональной системе. Чистый магний достаточно стоек в воздухе (почти не уступает алюминию). Раствор поваренной соли, морская вода, кислоты (кроме соляной) быстро разрушают магний; по отношению к щелочам магний стоек. При сгорании магний дает яркий белый свет; магний в 4 раза легче железа, поэтому его сплавы называют сверхлёгкими.
Вследствие того, что механические свойства чистого магния невысоки, поэтому в чистом виде его как конструкционный материал не применяют.
Химические свойства магния. Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел.
С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим.
Особенно интенсивно идет реакция с водяным паром, нагретым выше 380 оС.
По плотности магниевые сплавы разбиваются на легкие и сверхлегкие. К сверхлегким относится сплавы, легированные литием (МА21, МА18), а к легким – все остальные. Сплавы магния с литием (МА21, МА18) – самые легкие конструкционные металлические материалы.
При классификации по возможным температурам эксплуатации магниевых сплавы подразделяются на следующие группы:
- предназначены для работы при обычных температурах (сплавы общего назначения);
- жаропрочные (для длительной эксплуатации при температурах до 200°С);
- высокожаропрочные (для длительной эксплуатации при температурах до 250 – 300°С)
- предназначены для эксплуатации при криогенных температурах.
Различают термические упрочняемые и термически не упрочняемые сплавы.
Классификация и характеристика магниевых сплавов
Свойства магния значительно улучшаются при легировании. Сплавы магния характеризуются низкой плотностью, высокой удельной прочностью, способностью хорошо поглощать вибрации. Прочность сплавов при соответствующем легировании и термической обработке может достигать 350-400 МПа. Достоинством магниевых сплавов является их хорошая обрабатываемость резанием и свариваемость.
Недостатками магниевых сплавов являются плохие литейные свойства и склонность к газонасыщению, окислению и воспламенению при литье.
Для предотвращения дефектов при выплавке используют специальные флюсы, для уменьшения пористости применяют небольшие добавки кальция (0,2 %), а для снижения окисляемости – добавки бериллия (0,02-0,05 %).
Кроме того, меньшая коррозионная стойкость, чем у алюминиевых сплавов, трудности при выплавке и литье и необходимость нагрева при обработке давлением.
С другой стороны, такие элементы, как марганец, цирконий, цинк, титан улучшают коррозионную стойкость магния: при добавлении к магниевому сплаву нескольких девятых процентов титана коррозионная стойкость увеличивается в 3 раза.
Основными упрочняющими легирующими элементами в магниевых сплавах являются алюминий и цинк. Марганец слабо влияет на прочностные свойства. Его вводят главным образом для повышения коррозионной стойкости и измельчения зерна.
Термическая обработка магниевых и алюминиевых сплавов имеет много общего. Это объясняется близкими температурами плавления и отсутствием полиморфных превращений.
Для повышения прочностных свойств магниевые сплавы подвергают закалке и старению. Из-за низкой скорости диффузии закалку обычно проводят на воздухе, применяют искусственное старение при сравнительно высоких температурах (до 200 – 250 °С) и более длительных выдержках (16 – 24 ч).
Прочностные характеристики магниевых сплавов существенно повышаются при термомеханической обработке, состоящей в пластической деформации закаленного сплава перед его старением.
Магниевые сплавы обладают высокой пластичностью в горячем состоянии и хорошо деформируются при нагреве. Для деформированных сплавов диффузионный отжиг обычно совмещают с нагревом для обработки давлением. Магниевые сплавы хорошо обрабатываются резанием, легко шлифуются и полируются. Они удовлетворительно свариваются контактной роликовой и дуговой сваркой, которую рекомендуется проводить в защитной атмосфере (рис. 1).
Рис. 1. Сварка магниевых сплавов
Магниевые детали очень хорошо поглощают вибрацию. Их удельная вибрационная прочность почти в 100 раз больше, чем у лучших алюминиевых сплавов, и в 20 раз больше, чем у легированной стали. Это очень важное свойство при создании разнообразных транспортных средств.
Магниевые сплавы превосходят сталь и алюминий по удельной жесткости и поэтому применяются для изготовления деталей, подвергающихся изгибающим нагрузкам (продольным и поперечным). Магниевые сплавы немагнитны, совершенно не дают искры при ударах и трении, легко обрабатываются резанием (в 6 – 7 раз легче, чем сталь, в 2 – 2,5 раза – чем алюминий).
Магний и его сплавы обладают очень высокой хладостойкостью.
Возможности применения магния еще далеко не исчерпаны, а если учитывать широкое распространение магния в природе, относительную простоту способов его производства и ряд благоприятных свойств этого металла, можно полагать, что дальнейшее развитие металлургии магния будет в первую очередь определяться его общетехническим значением.
Магниевые сплавы обладают большей по сравнению с алюминиевыми и медными сплавами чувствительностью к скорости деформирования. Увеличение скорости деформирования при штамповке магниевых сплавов приводит существенному сужению допустимого температурного интервала.
В связи с этим штамповку магниевых сплавов рекомендуется деформировать на гидравлических или кривошипных прессах при пониженных скоростях деформирования. Рекомендуемые температурные интервалы штамповки некоторых марок магниевых сплавов приведены в табл.1, (рис. 2).
Химический состав и механические свойства некоторых отечественных магниевых сплавов (табл.2).
Таблица 1. Рекомендуемые температурные интервалы штамповки некоторых марок магниевых сплавов
Рис. 2. Последовательность операций получения заготовки из магниева сплава
Таблица 2. Химический состав и механические свойства отечественных магниевых сплавов
В основном деформируемые магниевые сплавы применяют в виде прутков и фасонных профилей для изготовления деталей горячей штамповкой (рис. 3). Для улучшения их пластичности обработку давлением проводят при температурах 350-450 °С, так как гексагональная решетка магния затрудняет их деформацию при комнатной температуре.
Рис. 3. Изделия из магниевых сплавов
Наиболее прочными деформируемыми сплавами являются сплавы магния с алюминием (МА5) и магния с цинком, дополнительно легированные цирконием (МА14, аналог американского сплава ZK60A), кадмием, РЗМ и другими элементами (МА15, МА19 и др.).
Алюминий и цинк являются эффективными упрочнителями твердого раствора. Однако их концентрация не должна превышать 10 и 6 % соответственно. При большем содержании этих элементов пластичность резко снижается. Появление при старении в структуре упрочняющих фаз Mg4Al3 и MgZn2 осуществляет дополнительное упрочнение. Цирконий измельчает зерно, а кадмий и редкоземельные элементы одновременно повышают и прочность, и пластичность.
Временное сопротивление высокопрочных магниевых сплавов после термической обработки составляет около 350 МПа. Сравнительно небольшой эффект упрочнения объясняется склонностью упрочняющих интерметаллидных фаз к коагуляции в процессе распада твердого раствора.
Сплав МА1, содержащий около 2 % Мц без других компонентов, характеризуется высокой пластичностью и применяется как листовой материал. Самыми легкими конструкционными материалами являются сплавы магния с литием (МА18, МА21).
Плотность сплава МА18 (аналог американского сплава LA91) составляет 1,3-1,65 г/см3. Магниеволитиевые сплавы обладают повышенной пластичностью и ударной вязкостью и могут обрабатываться давлением в холодном состоянии.
Эти сплавы хорошо свариваются и имеют удовлетворительную коррозионную стойкость.
Литейные магниевые сплавы
Литейные магниевые сплавы по химическому и фазовому составу близки к деформируемым.
По сравнению с деформируемыми литые детали позволяют существенно экономить металл. Высокая точность размеров и хорошее качество поверхности позволяют практически исключить операции механической обработки. Недостатком литейных магниевых сплавов являются более низкие механические свойства из-за грубозернистой структуры и усадочной пористости, связанной со сравнительно широким интервалом кристаллизации.
Для повышения прочности и модифицирования вводят кальций и цирконий. Дополнительное легирование кадмием повышает уровень механических и технологических свойств.
Наиболее распространенным магниевым литейным сплавом является MJI5, характеризующийся хорошей жидкотекучестью, малой склонностью к пористости и хорошей обрабатываемостью резанием. Отливки из этого сплава получают литьем в землю, в металлические формы и под давлением. Он идет на изготовление крупногабаритных отливок картеров двигателей, корпусов приборов, насосов, коробок передач для автомобилей и самолетов (рис. 4).
Для снижения массы деталей используют магниевые сплавы, легированные 12-13 % лития. Их жидкотекучесть находится на уровне сплава MЛ5. Сплавы Mg – Li не имеют склонности к образованию горячих трещин.
Рис. 4. Изделия из литейного магниева сплава
Применение магниевых сплавов
(рис. 5)
Благодаря малой плотности и высокой удельной прочности магниевые сплавы широко применяются в авиастроении. Из них изготавливают корпуса приборов, насосов, фонари и двери кабин. Фюзеляжи вертолетов фирмы Сикорского (США) почти полностью изготовлены из магниевых сплавов. В ракетной технике магниевые сплавы идут на изготовление корпусов ракет, обтекателей, стабилизаторов, топливных баков.
Теплоемкость магния примерно в 2,5 раза больше, чем у стали. Поглотив одинаковое количество тепла, он нагреется в 2,5 раза меньше. В кратковременном полете магниевые сплавы не успевают перегреться, несмотря на низкую температуру плавления. В кратковременно работающих ракетах типа “воздух – воздух” и управляемых снарядах магниевые сплавы составляют основную массу конструкции.
Применение магниевых сплавов позволило снизить массу ракет на 20-30 %.
Из литейных сплавов изготавливают кронштейны, элементы крепления, элероны, детали хвостового оперения, из деформируемых – обшивки корпусов, стрингеры, лонжероны, опорные конструкции тормозов, волноводов и другие детали.
Магниевые сплавы находят применение в транспортном машиностроении для изготовления картеров двигателей и коробок передач автомобилей.
Магниевые сплавы применяют в конструкциях переносных ручных и механизированных инструментов и машин (сверлильные и шлифовальные машины, пилы для лесной промышленности, газонные косилки, пневматические инструменты и др.).
Их используют в электротехнике и радиотехнике (корпуса приборов, электродвигателей), в текстильной промышленности (бобины, шпульки, катушки и др.) и других отраслях.
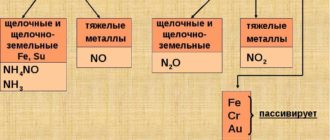
В связи с малой устойчивостью против коррозии изделия из магниевых сплавов подвергают оксидированию. На оксидированную поверхность дополнительно наносят лакокрасочные покрытия.
Важной областью применения магния является ядерная энергетика. Благодаря способности поглощать тепловые нейтроны, отсутствию взаимодействия с ураном и хорошей теплопроводности магниевые сплавы используют для изготовления оболочек тепловыделяющих элементов в атомных реакторах.
Высокий электроотрицательный потенциал магниевых сплавов позволяет применять их для протекторной защиты от морской коррозии судов и сооружений, эксплуатирующихся в морской воде, и для защиты от подземной коррозии находящихся в грунте газопроводов, нефтепроводов и т. п.
Рис. 5. Изделия из магниевых сплавов
Источник: https://extxe.com/8094/magnij-i-ego-splavy/
№12 Магний
Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита. Металлический магний впервые получил в 1808 английский химик Г. Дэви. Магний, полученный Дэви, был довольно грязным, чистый металлический магний получен впервые в 1828 французским химиком А. Бюсси.
Нахождение в природе, получение:
Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов — силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др.
Так, магний содержат широко распространенные силикаты оливин (Mg,Fe)2[SiO4] и серпентин Mg6(OH)8[Si4O10].
Важное практическое значение имеют такие магнийсодержащие минералы, как асбест, магнезит, доломит MgCO3•CaCO3, бишофит MgCl2•6H2O, карналлит KCl•MgCl2•6H2O, эпсомит MgSO4•7H2O, каинит KCl•MgSO4•3H2O, астраханит Na2SO4•MgSO4•4H2O и др.
Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах.
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2, натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния.
Другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,2MgO + 2CaO + Si = Ca2SiO4 + 2Mg.
Для получения магния используют не только минеральное сырье, но и морскую воду. Чистота рафинированного магния достигает 99,999% и выше.
Физические свойства:
Магний — серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Плотность магния ??? г/см3, он почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Температура плавления ???°C, температура кипения ???°C.
Химические свойства:
Отношение к воздуху и кислороду при обычных условиях: При нагревании: С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим.
В электрохимическом ряду напряжений магний стоит значительно левее водорода и активно реагирует с разбавленными кислотами с образованием солей. В этих реакциях есть у магния особенности.
Он не растворяется во фтороводородной, концентрированной серной и в смеси серной и в смеси азотной кислот, растворяющей другие металлы почти столь же эффективно, как «царская водка» (смесь HCl и HNO3). Не взаимодействует с растворами щелочей.
Важнейшие соединения:
Оксид магния, MgO: ???.
При хранении на воздухе оксид магния постепенно поглощает влагу и CO2, переходя в Mg(OH)2 и в MgCO3
Пероксид магния, MgO2: получен взаимодействием свежеосажденной Mg(OH)2 с 30%-ной H2O2.Бесцветное микрокристаллическое вещество, малорастворимое в воде и постепенно разлагающееся при хранении на воздухе.
Гидроксид магния, Mg(OH)2: белый, очень малорастворим в воде.
Помимо кислот, он растворим в растворах солей аммония (что важно для аналитической химии). Встречается в природе (минерал брусит).
Соли магния. Большинство солей магния хорошо растворимо в воде. Растворы содержат бесцветные ионы Mg2+, которые сообщают жидкости горький вкус. Заметно гидролизуются водой только при нагревании раствора.
Большинство солей выделяется из растворов в виде кристаллогидратов (напр. MgCl2*6H2O, MgSO4*7H2O).
MgSO4*7H2O в природе образует минерал «горькая соль«.При нагревании кристаллогидратов галоидных солей образуются труднорастворимые в воде основные соли.
К малорастворимым солям магния относится MgF2 (растворимость 0,08г/л), карбонат магния. Последний может быть получен реакцией обмена только при одновременном присутствии в растворе большого избытка CO2, в противном случае осаждаются основные соли.
Примером такой соли может служить «белая магнезия» — основная соль приблизительного состава 3MgCO3*Mg(OH)2*3H2O
Применение:
Основная часть добываемого магния используется для получения различных легких сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей.
Для защиты от коррозии водонагревателей и отопительных котлов находят применение магниевые аноды
Источник: http://www.kontren.narod.ru/x_el/info12.htm
Магний
| Атомный номер | 12 |
| Внешний вид простого вещества | лёгкий, ковкий, серебристо-белый металл |
| Атомная масса (молярная масса) | 24,305 а. е. м. (г/моль) |
| Радиус атома | 160 пм |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность (по Полингу) | 1,31 |
| Электродный потенциал | −2,37 В |
| Степени окисления | 2 |
| Плотность | 1,738 г/см³ |
| Молярная теплоёмкость | 24,90 Дж/(K·моль) |
| Теплопроводность | 156 Вт/(м·K) |
| Температура плавления | 922 K |
| Теплота плавления | 9,20 кДж/моль |
| Температура кипения | 1 363 K |
| Теплота испарения | 131,8 кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,210 c=5,21 Å |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Mg | 12 |
| 24,305 | |
| [Ne]3s2 | |
| Магний |
Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов , с атомным номером 12. Обозначается символом Mg Magnesium. Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья.
Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке.
С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
MgO + C = Mg + CO
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма.
tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2; Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма.
Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни.
А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Источник: http://himsnab-spb.ru/article/ps/mg
Химический элемент магний (Mg) — характеристика, строение и свойства металла
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Непосредственно магний впервые был получен Хэмфри Дэви в 1808 г. Учёный проводил электролиз белой магнезии, в которую он добавил небольшое количество воды и ртутной окиси. Эта реакция привела к образованию амальгамы металлического вещества. Полученный металл после выведения получил название «магний».
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
Вещество является представителем II группы периодической системы химических элементов.
Ему можно дать следующую характеристику:
- Магний принято обозначать Mg.
- Атомный номер вещества 12.
- Молярная масса элемента составляет 24,305 атомных единиц.
- Заряд ядра равен 12.
- В каждом атоме число электронов — 12.
- Кристаллическая решётка вещества имеет α-форму Ca гранецентрированная кубическая. Она отличается устойчивостью при обычной температуре.
- Плотность — 1,738 г/см³.
- Плавится металл при температуре 650 °C.
- Кипит вещество при 1090 °C.
- Чистый элемент отличается пластичностью. Его можно легко прессовать, прокатывать и резать.
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки.
Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло.
Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.
Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:
- Не вступает в реакцию с холодной водой, которая не насыщена воздухом.
- Постепенно вытесняет водород из кипятка.
- С водяным паром реагирует при температуре не ниже 400 °C.
- В жидком виде выделяет из влажного воздуха водород, поглощая его.
- Застывая, элемент практически полностью выводит водород.
- При нагревании водородной атмосферы до 400−500 °С вещество вступает в реакцию с ней, образуя гидрид магния.
- Вытесняет большую часть металлических элементов из растворов их солей, образованных на основании воды.
- В холодных условиях, соединяясь с влажным хлором, образует хлорид магния.
- В нагретом состоянии вступает в реакцию с галогенами.
- Большая часть солей элемента хорошо растворяется в воде.
- При контакте с едкими щелочами выпадает осадок, образованный из растворов солей магния.
- При пониженной температуре не вступает в реакцию с водными щелочными растворами, но подвержен растворению в гидрокарбонатах щелочных металлических реагентов и аммониевых солей.
- Не растворяется в концентрированной серной кислоте.
- От растворения в плавиковой кислоте защищён плёнкой из устойчивого фторида.
- Взаимодействует с разбавленными минеральными кислыми соединениями при низких температурах.
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
- карналлита;
- доломита;
- магнезита.
В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:
- Электролиз проходит при температуре от 720 до 750 °C.
- По мере выделения элементов состав ванны корректируется, часть электролита при этом удаляется, а сырьё добавляется.
- Расплавленный искомый металл всплывает на поверхность, и его регулярно извлекают.
- Полученное вещество содержит много примесей. Для очистки элемент проходит рафинирование в специальных печах под слоем флюсов.
- Очищенный металл разливают в изложницы.
- Следующая очистка заключается в том, что реагент сублимируют несколько раз в вакууме.
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов. Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ. Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования.
Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление.
Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.
Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
Источник: https://nauka.club/khimiya/magniy.html
Характеристика магния. Химический элемент магний
Химический элемент магний — двенадцатый по счету в таблице Менделеева. Он относится к второй группе и третьему периоду. Он входит в совокупность щелочноземельных металлов. Наука, которая изучает эти элементы, — химия.
Таблица Менделеева, опираясь на которую можно изучать данную науку, показывает нам, что протонов и нейтронов, содержащихся в атоме магния, по двенадцать.
Это можно определить по порядковому номеру (он равен количеству протонов, а электронов будет столько же, если это нейтральный атом, а не ион).
Химические особенности магния также изучает химия. Таблица Менделеева также необходима для их рассмотрения, так как она показывает нам валентность элемента (в данном случае она равняется двум). Она зависит от группы, к которой относится атом.
Кроме того, с ее помощью можно узнать, что молярная масса магния равняется двадцати четырем. То есть один моль данного металла весит двадцать четыре грамма.
Формула магния очень проста — он состоит не из молекул, а из атомов, объединенных кристаллической решеткой.
Характеристика магния с точки зрения физики
Как и все металлы, кроме ртути, данное соединение имеет твердое агрегатное состояние в нормальных условиях. Оно обладает светло-серой окраской со своеобразным блеском. Данный металл имеет довольно высокую прочность. На этом физическая характеристика магния не заканчивается.
Рассмотрим температуру плавления и кипения. Первая равняется шестисот пятидесяти градусам по шкале Цельсия, вторая составляет тысяча девяносто градусов Цельсия. Можно сделать вывод, что это достаточно легкоплавкий металл. Кроме того, он очень легкий: его плотность — 1,7 г/см3.
Зная физические особенности данного вещества, можно перейти ко второй части его характеристики. Данный металл обладает средним уровнем активности. Это можно увидеть из электрохимического ряда металлов — чем пассивнее он, тем правее находится. Магний является одним из первых слева. Рассмотрим по порядку, с какими веществами он реагирует и как это происходит.
С простыми
К таковым относятся те, молекулы которых состоят только из одного химического элемента. Это и кислород, и фисфор, и сера, и многие другие. Сначала рассмотрим взаимодействие с оксигеном. Оно называется горением. При этом образуется оксид данного металла.
Если сжечь два моля магния, потратив при этом один моль кислорода, получим два моля оксида. Уравнение данной реакции записывается следующим образом: 2Mg + О2 = 2MgO.
Кроме того, при горении магния на открытом воздухе образуется также его нитрид, так как данный металл параллельно реагирует с азотом, содержащимся в атмосфере.
При сжигании трех молей магния тратится один моль нитрогена, и в результате получаем один моль нитрида рассматриваемого металла. Уравнение такого рода химического взаимодействия можно записать таким образом: 3Mg + N2 = Mg3N2.
Кроме того, магний способен реагировать и с другими простыми веществами, такими как галогены. Взаимодействие с ними происходит только при условии нагревания компонентов до очень высоких температур. В таком случае происходит реакция присоединения. К галогенам относятся такие простые вещества: хлор, йод, бром, фтор.
И реакции называются соответствующе: хлорирование, йодирование, бромирование, фторирование. Как уже можно было догадаться, в результате таких взаимодействий можно получить хлорид, йодид, бромид, фторид магния. К примеру, если взять один моль магния и столько же йода, получим один моль йодида данного металла. Выразить эту химическую реакцию можно с помощью следующего уравнения: Mg + І2 = MgI2.
По такому же принципу проводится и хлорирование. Вот уравнение реакции: Mg + Cl2 = MgCl2.
Кроме этого, металлы, в том числе и магний, реагируют с фосфором и серой. В первом случае можно получить фосфид, во втором — сульфид (не путать с фосфатами и сульфатами!). Если взять три моля магния, добавить к нему два моля фосфора и разогреть до нужной температуры, образуется один моль фосфида рассматриваемого металла.
Уравнение данной химической реакции выглядит следующим образом: 3Mg + 2Р = Mg3P2. Точно так же, если смешать магний и серу в одинаковых молярных пропорциях и создать необходимые условия в виде высокой температуры, получим сульфид данного металла. Уравнение подобного химического взаимодействия можно записать так: Mg + S = MgS.
Вот мы и рассмотрели реакции этого металла с другими простыми веществами. Но химическая характеристика магния на этом не заканчивается.
Реакции со сложными соединениями
К таким веществам относятся вода, соли, кислоты. С разными группами химических веществ металлы реагируют по-разному. Рассмотрим все по порядку.
Магний и вода
При взаимодействии данного металла с самым распространенным химическим соединением на Земле образуется оксид и водород в виде газа с резким неприятным запахом. Для проведения такого рода реакции компоненты также нужно нагреть. Если смешать по одному молю магния и воды, получим по столько же оксида и водорода. Уравнение реакции записывается следующим образом: Mg + Н2О = MgO + Н2.
Взаимодействие с кислотами
Как и другие химически активные металлы, магний способен вытеснять атомы гидрогена из их соединений. Такого рода процессы называются реакциями замещения.
В таких случаях происходит замена атомами металлов атомов гидрогена и формирование соли, состоящей из магния (или другого элемента) и кислотного осадка.
Например, если взять один моль магния и добавить его к соляной кислоте в количестве два моля, образуется один моль хлорида рассматриваемого металла и столько же водорода. Уравнение реакции будет выглядеть так: Mg + 2HCl = MgCl2 + Н2.
Взаимодействие с солями
Как из кислот образуются соли, мы уже рассказали, но характеристика магния с точки зрения химии подразумевает и рассмотрение его реакций с солями. В данном случае взаимодействие может произойти, только если металл, входящий в состав соли, менее активен, чем магний.
К примеру, если взять по одному молю магния и сульфата меди, получим сульфат рассматриваемого металла и чистую медь в равном молярном соотношении. Уравнение такого рода реакции можно записать в следующем виде: Mg + CuSO4 = MgSO4 + Cu.
Здесь проявляются восстановительные свойства магния.
Применение данного металла
Благодаря тому что он по многим параметрам превосходит алюминий — легче его приблизительно в три раза, но при этом в два раза прочнее, он получил широкое распространение в различных отраслях промышленности. В первую очередь это авиастроение.
Здесь сплавы на основе магния занимают первое место по популярности среди всех используемых материалов. Кроме того, он используется в химической промышленности в качестве восстановителя для добывания некоторых металлов из их соединений.
Благодаря тому что при горении магний образует очень мощную вспышку, его используют в военной промышленности для изготовления сигнальных ракет, светошумовых боеприпасов и др.
Получение магния
В основном сырьем для этого служит хлорид рассматриваемого металла. Делается это путем электролиза.
Качественная реакция на катионы данного металла
Это специальная процедура, предназначенная для того, чтобы определить присутствие ионов какого-либо вещества. Чтобы протестировать раствор на наличие соединений магния, можно добавить к нему карбонат калия или натрия. В результате образуется белый осадок, который легко растворяется в кислотах.
Где этот металл можно найти в природе?
Данный химический элемент является довольно распространенным в природе. Земная кора почти на два процента состоит из этого металла. Он встречается в составе многих минералов, таких как карналлит, магнезит, доломит, тальк, асбест. Формула первого минерала выглядит так: KCl•MgCl2•6Н2О.
Он выглядит как кристаллы голубоватого, бледно-розового, блекло-красного, светло-желтого либо прозрачного цвета. Магнезит — это карбонат магния, его химическая формула — MgCO3. Он имеет белую окраску, но в зависимости от примесей, может иметь серый, бурый или желтый оттенок. Доломит имеет следующую химическую формулу: MgCO3•СаСО3.
Это желтовато-серый либо цвета охры минерал, обладающий стеклянным блеском.
Тальк и асбест имеют более сложные формулы: 3MgO•4SiO2•Н2О и 3MgO•2SiO2•2Н2О соответственно. Благодаря своей высокой жароустойчивости они широко используются в промышленности. Кроме того, магний входит в химический состав клетки и структуру многих органических веществ. Это мы рассмотрим подробнее.
Роль магния для организма
Данный химический элемент важен как для растительных, так и для животных существ. Магний для организма растений просто жизненно необходим. Так же, как железо является основой гемоглобина, нужного для жизни животных, так магний представляет собой главный компонент хлорофилла, без которого не может существовать растение. Данный пигмент участвует в процессе фотосинтеза, при котором в листьях синтезируются из неорганических соединений питательные вещества.
Магний для организма животных также очень нужен. Массовая доля данного микроэлемента в клетке — 0,02-0,03%. Несмотря на то что его так мало, он выполняет очень важные функции. Благодаря ему поддерживается структура таких органоидов, как митохондрии, отвечающие за клеточное дыхание и синтез энергии, а также рибосомы, в которых образуются белки, необходимые для жизнедеятельности.
Кроме того, он входит в химический состав многих ферментов, которые нужны для внутриклеточного обмена веществ и синтеза ДНК.
Для организма в целом магний необходим, чтобы принимать участие в обмене глюкозы, жиров и некоторых аминокислот. Также с помощью данного микроэлемента может передаваться нервный сигнал. Кроме всего вышеперечисленного, достаточное содержание магния в организме снижает риск сердечных приступов, инфарктов и инсультов.
Симптомы повышенного и пониженного содержания в организме человека
Недостаток магния в организме проявляется такими основными признаками, как повышенное артериальное давление, усталость и низкая работоспособность, раздражительность и плохой сон, ухудшение памяти, частое головокружение.
Также может наблюдаться тошнота, судороги, дрожь в пальцах, спутанность сознания — это признаки очень пониженного уровня поступления с едой данного микроэлемента. Недостаток магния в организме приводит к частым респираторным заболеваниям, нарушениям в работе сердечно-сосудистой системы, а также диабету второго типа.
Далее рассмотрим содержание магния в продуктах. Чтобы избежать его недостатка, нужно знать, какая еда богата данным химическим элементом. Нужно учитывать еще и то, что многие из этих симптомов могут проявляться и при обратном случае — избытке магния в организме, а также при недостатке таких микроэлементов, как калий и натрий.
Поэтому важно внимательно пересмотреть свой рацион и разобраться в сути проблемы, лучше всего это сделать с помощью специалиста-диетолога.
магния в продуктах
Как было упомянуто выше, данный элемент является основной составляющей хлорофилла. Поэтому можно догадаться, что большое его количество содержится в зелени: это сельдерей, укроп, петрушка, цветная и белокочанная капуста, листья салата и т. д. Также это многие крупы, в особенности гречка и пшено, а еще овсянка и ячневая. Кроме того, данным микроэлементом богаты орехи: это и кешью, и грецкий орех, и арахис, и фундук, и миндаль.
Также большое количество рассматриваемого металла содержится в бобовых, таких как фасоль и горох. Немало его содержится и в составе водорослей, к примеру в морской капусте. Если употребление данных продуктов происходит в нормальном количестве, то ваш организм не будет испытывать недостатка в рассмотренном в этой статье металле. Если же у вас нет возможности регулярно кушать еду, перечисленную выше, то лучше всего приобрести пищевые добавки, в состав которых входит этот микроэлемент.
Однако перед этим нужно обязательно проконсультироваться с врачом.
Вывод
Магний — один из самых важных металлов в мире. Он нашел широкое применение в многочисленных отраслях промышленности — от химической до авиационной и военной. Более того, он очень важен с биологической точки зрения. Без него невозможно существование ни растительных, ни животных организмов. Благодаря данному химическому элементу, осуществляется процесс, дающий жизнь всей планете, синтез.
Источник: https://FB.ru/article/155200/harakteristika-magniya-himicheskiy-element-magniy
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2. Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья.
Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме.
Чистота рафинированного магния достигает 99,999 % и выше.Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:MgO + C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция.
С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = CaSiO3 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, пространственная группа P 63/mmc.
При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2.
Плотность магния при 20 °C — 1,737 г/см³, температура плавления металла tпл = 651 °C, температура кипения — tкип = 1103 °C, теплопроводность при 20 °C — 156 Вт/(м·К). Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Вещество магний
Магний – лёгкий серебристо-белый металл, блестящий, но тускнеющий на воздухе из-за образования защитной оксидной плёнки на его поверхности. Химическая формула магния – Mg. 12 — атомный номер магния в периодической системе химических элементов Д.И. Менделеева.
Магний довольно распространён в земной коре. Опережают магний в этом плане только кислород, кремний, алюминий, железо и кальций. В природе он встречается в виде соединений. Важнейшие минералы, содержащие магний – магнезит MgCO3 и двойная соль доломит CaMg[CO3]2. Огромные запасы магния содержатся в морях и океанах в виде MgCl2. Науке известно около 1500 минералов. И почти 200 из них содержат магний.
Химические свойства магния
Магний – активный металл. И как все активные металлы, он хорошо горит. В обычных условиях его поверхность защищена оксидной плёнкой. Но при нагревании до 600 градусов плёнка разрушается, и магний реагирует с кислородом. Продукт горения магния – оксид магния, белый порошок.
2Mg + O2 = 2MgO
При горении выделяется много тепла и света. Причём по своему спектральному анализу свет при горении магния почти такой же, как солнечный свет. Это свойство использовали первые фотографы более 100 лет назад. Горение магниевого порошка с добавками перманганата калия или нитрата бария освещало объект фотографирования, что позволяло делать чёткие снимки в закрытом помещении, где освещение было недостаточным.
Магний вступает в реакцию с водой только при нагревании. В результате этой реакции выделяется водород.
Mg + 2H2O = Mg(OH)2 + H2
Горит магний и в среде углекислого газа.
2Mg + CO2 = 2MgO + C
С галогенами магний взаимодействует при комнатной температуре.
Mg + Br2 = MgBr2
С серой магний вступает в реакцию только при нагревании, образуя сульфид магния.
Mg + S = MgS
В реакцию со щелочами магний не вступает.
Применение магния
Способность магния легко взаимодействовать с кислородом позволяет использовать его в производстве стали для удаления кислорода, растворённого в расплавленных металлах. Магниевый порошок применяется в ракетостроении как высококалорийное горючее. Высокоочищенный магний используют в производстве полупроводников.
Магний – самый лёгкий из металлов. Он в четыре раза легче железа и в полтора раза легче алюминия. В чистом виде магний мягкий и непрочный. Из него нельзя делать технические конструкции. Но механическая прочность магния значительно повышается, если в него добавить цинк, алюминий или марганец. Добавки вводят в небольшом количестве, чтобы не увеличить удельный вес магния. К сожалению, эти сплавы при нагревании теряют свою прочность.
Но если к ним добавить цинк, медь, серебро, бериллий, торий, цирконий, титан, то они сохраняют свою механическую прочность даже при повышении температуры. Корпуса из магниевых сплавов можно обнаружить в мобильных телефонах, видеокамерах, ноутбуках. Кроме того, детали из магниевых сплавов поглощают вибрацию в 100 раз лучше алюминия и в 20 раз лучше легированной стали.
Поэтому их широко применяют в авиации, автомобилестроении и других областях техники.
Источник: http://ximik.biz/himicheskie-elementi/75-veshestvo-magniy
Магний (Mg, Magnesium)
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
- крупы (пшено и гречка)
- горох, фасоль, лесные орехи, тахинная халва
- сухое молоко, арбуз, пшеничные отруби, шпинат, соевая мука
- ржаной хлеб, абрикосы, лимон, грейпфрут
- печень говяжья, мясо кролика, свинина
- пшеничный хлеб, кукуруза, морковь, салат
- молочные продукты, рыба, яйца
- картофель, репчатый лук, белокочанная капуста
- томаты, зелёный лук, свёкла
- яблоки, сливы.
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
- понос, тошноту, рвоту
- сонливость, замедление пульса
- нарушения координации, речи
- высыхание слизистых (во рту и носу).
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
https://www.youtube.com/watch?v=I0jnGDhMEOk
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Источник: http://www.calorizator.ru/element/mg