Паяльная кислота своими руками: состав и предназначение, изготовление своими руками — Станок
Паяльная кислота является тем флюсом, который можно отнести к отдельной категории, ведь он влияет агрессивно на материалы, которые необходимы при работе. Этот флюс в основном распространяется в жидком состоянии, причем это не зависит от его концентрации. Иногда можно приобрести концентрированное вещество, а потом разбавить его, а возможно и купить уже готовое, разбавленное. Кроме этого каждый вполне может сделать паяльную кислоту самостоятельно.
Свойства материалов необходимо подбирать по тем факторам, которые необходимы для их применения.
Кислота для спаивания предназначается для тех металлов, которые имеют сильные загрязнения, ведь на них происходит окисление, а также на поверхности остается большое количество ржавчины.
Материал очень активен, поэтому необходимо работать с ним осторожно и избегать попадания на кожные покровы и слизистые оболочки человека. Необходимо сначала внимательно ознакомиться с правилами и методами применения кислоты, а уже потом начинать применять ее по назначению.
В процессе производства паяльной кислоты самостоятельно, необходимо использовать специальную технологию. В конце должен получиться тот материал, который будет иметь те свойства, предписанные ГОСТом. Именно это сделает флюс качественным и надежным, чтобы соединения были прочными.
Необходимо сделать так, чтобы свойства и функции кислоты работали и после спаивания металлов, ведь материл убирает пленки и ржавчину с поверхности, а также препятствует их повторному возникновению.
Следует также учитывать растекаемость по поверхности спаиваемых материалов и схватываемость с металлами и изделиями.
Характеристики, состав и свойства
Необходимо точно знать, из чего должен состоять материал, и только потом приступать к его производству. В кислоту для спаивания входят:
- присадка смачивающая;
- хлорид амония;
- деионизированная вода;
- хлорид цинка;
- соляная кислота.
Паяльная кислота, созданная самостоятельно, может состоять из других компонентов. Необходимо только сделать все для того, чтобы флюс обладал всеми необходимыми свойствами. Следует обеспечить высокую активность данного материала.
Он должен за минимальное количество времени вступить во взаимодействие с необходимыми материалами, а также уничтожить все вещества, которые не дают нормально спаиваться. Однако стоит учитывать, что мелкие детали при действии кислоты могут пострадать и испортиться.
Такие же свойства имеются и у паяльного активного жира.
У кислоты довольно неприятный запах, поэтому когда человек вдыхает его, то его здоровье может пострадать. Именно поэтому при работе с данным материалом обязательно рекомендуется пользоваться респиратором.
Ну а помещение для работы необходимо постоянно проветривать.
Необходимо обезопасить руки, кожные покровы и слизистые от попадания кислоты, нужно, чтобы заготовка попадала только в необходимые для спаивания места.
Материалы и инструменты для изготовления кислоты
Необходимо знать, что кислота для спаивания, сделанная самостоятельно, будет несколько другого состава, нежели покупная. Однако она будет более простой. Чтобы приготовить такую кислоту, необходимо пользоваться некоторыми приспособлениями:
- Стеклянная емкость или банка для замешивания и приготовления материала.
- Цинк в гранулах или стаканчики от использованных батареек с содержанием данного элемента.
- Водопроводная чистая вода.
- Соляная кислота концентрированная, которая способна растворять ненужные примеси и вещества.
Изготовление кислоты самостоятельно
Для начала необходимо взять емкость или баночку для замешивания кислоты. Именно туда помещается цинк или батарейки и их остатки.
Только после всего вышеперечисленного в емкость можно наливать соляную кислоту. Главное при этом действовать с большой осторожностью, ведь при попадании на кожу можно получить серьезный ожог.
Кислоты в емкости не должно быть больше, чем 3/4 от объема всего состава.
В итоге получается, что пропорции должны быть такими. Для 1 литра соляной кислоты необходимо 412 грамм цинка, вот только измерить это можно только при помощи специальных инструментов. Поэтому стоит знать, что будут некоторые отклонения в ту или иную сторону.
При дальнейшем приготовлении паяльной кислоты необходимо подождать, когда закончится реакция химических веществ. Цинк и кислота контактируют между собой, металл постепенно растворяется. Во время этого процесса происходит активное выделение водорода, поэтому в жидкости можно увидеть множество пузырьков.
Жидкость постепенно становится все прозрачней и чище. Когда все процессы будут закончены, необходимо перелить жидкость в плотно закрывающуюся тару. Все данные материалы можно с легкостью купить в магазинах, специализирующихся на продаже химии и реактивов. При использовании батареек можно увидеть, что подходят практически любые из них.
Если необходимо сделать материал с более слабыми свойствами, то следует немного убавить агрессивность. В этом случае рекомендуется добавить немного воды, чтобы раствор получился более жидким и со слабыми свойствами.
Однако нужно соблюдать осторожность, ведь жидкость может разбрызгаться и попасть на кожные покровы и слизистые оболочки человека.
Пропорции в данном случае следует выбирать самому, придерживаясь особенностей необходимой пайки.
Приготовление паяльной кислоты самостоятельно
Для начала стоит позаботиться о собственной безопасности, ведь пользоваться кислотой очень опасно и можно нанести непоправимый вред здоровью. Если производство кислоты осуществляется на предприятиях и в промышленных областях, то все необходимо делать в шкафах специального назначения.
Реактивы надежно защищены от посторонних, а переливаются они строго под специальными вытяжками. В домашних условиях рекомендуется пользоваться защитой, перчатками, очками, респираторами и другими приспособлениями. Растворение кислоты следует производить только в хорошо проветриваемом помещении или вообще на улице.
Ведь в процессе создания кислоты для спаивания в воздух постоянно выделяется водород в больших количествах. Также необходимо позаботиться на всякий случай и о воде, при помощи которой можно быстро промыть участок кожи, на который попало вещество.
Лучше всего использовать водопроводную холодную воду, ведь в результате несчастного случая она уменьшит боль и быстро промоет рану.
Если данное вещество разлилось по поверхности, то лучше всего его смывать специальным составом воды и щелочи.
Также нужно обязательно помнить о том, что данный материал необходимо правильно хранить, емкость должна быть закрытой и сохранять герметичность, хранение осуществляется в темном и прохладном месте.
Рекомендуется исключить доступ посторонних людей к паяльной кислоте, чтобы не возникало опасности для других. Флюс иногда производится из чистой соляной кислоты без цинка и воды. Однако применят его по большей части только для изделий из железа.
Источник: https://regionvtormet.ru/beton/payalnaya-kislota-svoimi-rukami-sostav-i-prednaznachenie-izgotovlenie-svoimi-rukami.html
Поиск данных по Вашему запросу:
Соляная кислота хлороводородная кислота — раствор хлористого водорода в воде; сильная одноосновная кислота, формула HCl. Соляная кислота синтетическая применяется в химической, медицинской, пищевой промышленности, цветной и черной металлургии. Продукт перевозится в специальных гуммированных цистернах по 42—70 т, полимерных бочках, контейнерах.
На синтетическую соляную кислоту имеется Сертификат соответствия и Сертификат на применение продукта в технологических процессах добычи и транспорта нефти.
Кислота соляная абгазная используется в химической промышленности для подкисления рассола в производстве каустической соды, для получения регенерированного хлористого водорода, для получения хлоридов металлов, в черной и цветной металлургии — для снятия окисной пленки с поверхности металла, в процессе выщелачивания металла из руд; в других отраслях промышленности — для очистки котлов и для химводоочистки, не связанной с питьевым водоснабжением.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Соляная кислота. Травим цинком.
Рецепты паяльной кислоты
Соляная кислота в смеси с водой и другими материалами применяется для удаления накипи в системе охлаждения автомобильных двигателей, для травления поверхности металлических изделий перед лужением и пайкой и для приготовления травленой кислоты путем раствора в ней чистого цинка.
Растворы их обладают антисептическими свойствами. Раствор хлорида цинка в соляной кислоте травленая кислота используют при пайке металлов, так как он способствует удалению с поверхности металлов оксидов и гидроксидов.
Механизм этого процесса сводится к образованию комплексных соединений. Успешность пайки связана с качеством подготовки поверхности она должна быть по возможности хорошо зачищена и с родом флюса, применяемого для очистки поверхности изделия от окислов и для предохранения ее от окисления в процессе пайки. При пайке нормальными мягкими припоями в качестве флюсов пользуются травленой кислотой , а также канифолью.
Иногда раствор хлористого цинка приготовляют непосредственно растворением цинка в соляной кислоте. Этот процесс обычно называют травлением, поэтому раствор хлористого цинка иногда называют травленой кислотой. Затем, чтобы очистить, его натирают острым концом в нашатыре или канифоли и, не давая остыть, очищенным острым концом дотрагиваются до припоя, который к нему и прилипает в небольшом количестве.
Концом паяльника с прилипшим к нему припоем проводят по спаиваемому месту, предварительно смазанному травленой кислотой. В это время спаиваемая поверхность должна быть неподвижна. Необ одимо следить за тем, чтобы спаиваемые части были плотно прижаты друг другу. При кислотной пайке и лужении деталей из латуни, меди, стали применяют хлористый цинк травленая кислота , а при бескислотной пайке деталей из меди и латуни — канифоль или паяльный жир.
При пайке твердыми припоями в качестве флюса применяют борнокислый натрий буру или борную кислоту. В качестве припоя и сейчас используют легкоплавкий сплав свинца с оловом, а восстановителем служит так называемая травленая кислота — раствор хлорида цинка в соляной кислоте. Для этого подшипник нагревают до 60 — 70 С, смачивают раствором соляной кислоты, протирают я промывают водой.
Затем подшипник смачивают травленой кислотой , посыпают порошком нашатыря хлоридом аммония , нагревают до — С и палочкой припоя наносят тонкий слой полуды, которая должна равномерно покрывать поверхность и не стекать с нее.
Луженую поверхность протирают паклей с порошком нашатыря. После лужения незамедлительно заливают баббитом для того, чтобы предотвратить появление на слое полуды оксидных пленок.
Для лужения растиранием третника вкладыш с тыльной стороны нагревают до 60 — 70 С. Поверхность, подвергаемую лужению, смачивают соляной кислотой, протирают, промывают горячей водой и вытирают насухо. Затем облуживаемую поверхность смачивают травленой кислотой НС1 , посыпают порошком нашатыря и нагревают вкладыш до — С. Палочкой третника наносят тонкий слой расплавленной полуды, которая должна дать ровную блестящую поверхность.
Хлористый цинк представляет собой белый порошок, легко впитывающий влагу. Его хранят в плотно закрывающейся посуде. Водный раствор хлористого цинка, полученный путем химической реакции цинка с соляной кислотой травленая кислота , использовать в качестве флюса для пайки ответственных деталей не рекомендуется, так как он обладает повышенной коррозийной актив-ностыб активность может быть снижена выпариванием из раствора воды и остатков кислоты.
Следующей операцией является травление подшипника соляной кислотой. Травленая соляная кислота представляет процентный водный раствор хлористого цинка. Целью травления подшипников перед лужением является удаление с них твердой пленки окислов, мешающей приставанию полуды и баббита.
Травленая кислота приготовляется растворением в соляной кислоте металлического цинка из расчета 0 3 кг на 1 кг кислоты. Поверхность подшипника — покрывается кислотой посредством смоченной в ней кисточки. На поверхности подшипника после этого не должно быть сухих мест, наличие которых свидетельствует о плохой очистке поверхности от жировых веществ, вследствие чего полуда в этих местах не будет приставать.
Поэтому, если при травлении обнаруживаются места, не смоченные травленой кислотой, их следует вновь подвергнуть очистке. Поэтому, если при травлении обнаруживаются места, не смоченные травленой кислотой , их следует вновь подвергнуть очистке.
Старую заливку удаляют, выплавляя ее на спокойном ровном огне. Шкуркой или стальной щеткой тщательно зачищают до металлического блеска всю поверхность вкладыша, которая будет заливаться сплавом. После обезжиривания для удаления остатков щелочи вкладыш промывают в горячей воде. После прогрева поверхность перед лужением смазывают травленой кислотой и покрывают порошком нашатыря.
Источник: https://all-audio.pro/c33/obsuzhdeniya/kak-travit-solyanuyu-kislotu.php
Кислота для удаления ржавчины
Наиболее страшным врагом металлоконструкций является ржавчина, которая появляется из-за взаимодействия кислорода с водой. Существует достаточно много разных способов устранения коррозионных очагов с поверхности металла, но наибольшей эффективностью отличается соляная кислота для удаления ржавчины. Она может использоваться в чистом виде или в качестве основного компонента современных химических составов для устранения коррозии.
Существует несколько основных методов очистки металлоконструкций от ржавых пятен, исходя из степени коррозионного процесса:
- погружной, погружая деталь в раствор;
- одноразовое или многоразовое обрабатывание изделий соляной кислотой вручную;
- проведение обработки металла с предварительной механической очисткой.
Что собой представляет соляная кислота
Соляная кислота — это растворимый в воде продукт неорганического происхождения. Данное вещество внешним видом похоже на желтый сироп.
У соляной кислоты самое разное применение, но наибольшую популярность она получила в качестве средства для устранения ржавых пятен. С помощью соляной кислоты можно не только очистить рыхлую ржавчину, но и получить защитную пленку маслянистого типа.
После того, как кислота разъест ржавчину, появится защитный слой поверхность.
Преимущества соляной кислоты:
- устранение налета ржавчины с поверхности металлоконструкций, а также на эмали и фаянсе;
- деликатное устранение коррозии, без травмирования поверхностей;
- создание защитного покрытия на поверхности конструкций для предупреждения дальнейшего появления коррозии;
- очищение налетов и загрязнений с сантехники.
Особенности профессиональных удалителей ржавчины на основе соляной кислоты
Химические удалители ржавчины изготавливаются для очистки коррозии с разных видов металлических конструкций. Удалители ржавых пятен являются профессиональными средствами с высоким уровнем концентрации, которые должны пропорционально разбавляться водой в рекомендованной производителем пропорции (1:3).
Предварительно необходимо протестировать действие химического вещества на маленьком участке металлоконструкции, чтобы подобрать оптимальное соотношение активного вещества и воды, ориентируясь на глубину и количество разрушения. При воздействии воды и воздуха на удалитель, он не выделяет токсины.
Средство является взрывобезопасным и пожаробезопасным.
Основные требования по технике безопасности при работе с кислотами
При устранении ржавчины кислотными составами необходимо придерживаться требований техники безопасности и рекомендаций изготовителя химического состава. Все процедуры нужно проводить исключительно в специальных перчатках из плотной резины, строительных защитных очках, маске и сменной одежде.
В том случае если специальная одежда для проведения работ отсутствует, можно закрыть свою одежду с помощью фартука. Если кислота попадет на участки кожи или в глаза, требуется как можно быстрее промыть пораженное место большим количеством проточной воды.
Если боли и дискомфорт беспокоят долгое время, нужно обратиться за помощью в медклинику.
Источник: https://syntilor.ru/udalitel-rzhavchiny/kislota-dlya-udaleniya-rzhavchiny/
Как удалить цинковое покрытие с металла?
Цинкование признано во всем мире наиболее эффективным способом защиты металлоконструкций, труб, проволоки, болтов, гаек и прочей метизной продукции от негативного воздействия окружающей среды. Благодаря относительной дешевизне технологии цинкования, цены на оцинкованные изделия гораздо ниже цен на нержавеющие метизы. Но если потребуется соединить элементы при помощи сварки, то цинковое покрытие может стать серьезной проблемой.
Особенности сварки оцинкованного металла
Необходимость удаления цинковых покрытий с металлов возникает, как правило, при сварочных работах. Каждый сварщик знает, что сваривать оцинкованные поверхности проблематично и даже самый тонкий слой цинка способен сильно ухудшить прочностные свойства сварного шва.
Примесь цинка, попавшая в сварочную ванну, приводит к порообразованию и появлению кристаллизационных трещин в шве, то есть не дает получить плотный и равномерный шов.
Кроме этого, в ходе сварки цинк под воздействием высокотемпературной дуги начинает улетучиваться, а его ядовитые пары способны вызвать сильное отравление и даже удушье сварщика, особенно при работе в плохо проветриваемом помещении.
Способы удаления цинка со свариваемых поверхностей
Механический. Нежелательное цинковое покрытие с металлических поверхностей можно убрать при помощи абразивного зачистного круга. Иногда достаточно зачистить деталь до металлического блеска щеткой с жесткой проволочной щетиной (кордщеткой).
Термический. Эффективным способом удаления металлического покрытия является выжигание цинка высокотемпературным пламенем, например, с помощью газового резака. При этом следует помнить о токсичности цинка и предпринять все меры безопасности.
Химический. При сварке ответственных конструкций предварительное очищение поверхностей от цинка лучше производить в слабом растворе соляной кислоты (5 %). Цинк активнее стали, поэтому он эффективно вступает в реакцию с кислотой и легко удаляется с метизов. Для предотвращения кислотной коррозии стали в раствор можно добавить 1 % уротропина.
Свариваемая часть детали погружается в ванну с разбавленной кислотой комнатной температуры. Процесс очищения (травления) длится несколько минут.
Когда он завершится, а это будет видно по затуханию шипения, металл обрабатывают щелочью для нейтрализации кислоты, например, раствором соды (1г / 50мл), затем промывают водой и сушат до полного испарения влаги.
Многие сварщики для химического травления свариваемых оцинкованных деталей используют проверенное и действенное средство – отработанный кислотный аккумуляторный электролит, который есть не что иное, как водный раствор серной кислоты. Всего несколько минут в такой ванне и от цинкового покрытия на металле не останется и следа.
Полезные советы 20.09.2019 12:51:11
Отзывы могут оставлять только зарегистрированные пользователи. Пожалуйста, зарегистрируйтесь
Источник: https://Krepcom.ru/blog/poleznye-sovety/kak-udalit-tsinkovoe-pokrytie-s-metalla/
О соляной кислоте
Соляная кислота – это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц
Соляная кислота представляет собой раствор газообразного хлористого водорода HCl в воде. Последний представляет собой гигроскопичный бесцветный газ с резким запахом. Обычно употребляемая концентрированная соляная кислота содержит 36 – 38% хлористого водорода и имеет плотность 1, 19 г/см3.
Такая кислота дымит на воздухе, так как из неё выделяется газообразный HCl; при соединении с влагой воздуха образуются мельчайшие капельки соляной кислоты. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Однако такие металлы, как золото,платина, серебро, вольфрам и свинец, соляной кислотой практически не травятся.
Многие недрагоценные металлы, растворяясь в кислоте, образуют хлориды, например цинк:
Zn + 2HCl = ZnCl2 + H2
Чистая кислота бесцветна, а техническая имеет желтоватый оттенок, вызванный следами соединений железа, хлора и других элементов (FeCl3). Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HClи не дымят ни в сухом, ни во влажном воздухе.
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий.
Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е.
в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Отравление соляной кислотой
HCl ядовит. Отравления происходят обычно туманом, образующимся при взаимодействии газа с водяными парами воздуха. HCl поглощается также на слизистых оболочках с образованием кислоты, вызывающей их сильное раздражение.
При длительной работе в атмосфере HCl наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0, 005 мг/л.
Для защиты используют противогаз, защитные очки, резиновые перчатки, обувь, фартук.
В то же время, наше пищеварение невозможно без соляной кислоты, её концентрация в желудочном соке достаточно высока. Если в организме кислотность понижена, то пищеварение нарушается, и врачи прописывают таким больным приём соляной кислоты перед началом еды.
Применение в быту соляной кислоты
Концентрированная «солянка» смешивается с водой в любой пропорции для бытовых нужд. Сильный раствор этой неорганической кислоты без труда очищает фаянсовую сантехнику от известкового налета и ржавчины, а более слабым можно убрать с тканей пятна ржавчины, чернил, ягодного сока.
Если приглядитесь, на средстве для чистки унитазов «Туалетный утенок» написано, что в состав сходит соляная кислота, поэтому работать с ним нужно в резиновых перчатках и беречь глаза от попадания в них брызг.
Кроме того, без этой кислоты немыслима жизнь ни одного человека – она содержится в желудке и именно благодаря ей пища, попавшая в желудок, растворяется (переваривается).
К тому же, эта кислота служит первым барьером от болезнетворных бактерий, попавших в желудок – они погибают в кислой среде.
Ну а людям, страдающим от гастрита с повышенной кислотностью, эта кислота тоже хорошо знакома. Они даже уменьшают ее действие, чтобы она не разрушала стенки желудка, с помощью специальных препаратов, которые взаимодействуют с ней и уменьшают ее концентрацию.
Самые популярные – это препараты, содержащие оксиды магния и алюминия, например, «Маалокс». Впрочем, есть и экстремальщики, которые пьют пищевую соду, хотя уже доказано, что это приводит лишь к временному облегчению.
Источник: https://xn--c1acbdje2abnav6d.xn--p1ai/stati_o_kislotah/o-soljanoj-kislote
Соляная кислота для очистки канализации
Соляная кислота – это однородная бесцветная жидкость с резким запахом. Является очень едким веществом, взаимодействующим с большинством металлов. Благодаря этим свойствам материал широко применяется не только в промышленности, но и в быту.
Реагент входит в состав различных средств для избавления от канализационных засоров, но его можно использовать для этой цели и самостоятельно, предварительно разбавив водой в нужных пропорциях.
Этим применение кислотного раствора в доме не ограничивается: материал используют для очистки сантехники от ржавчины и известкового налета, устранения трудновыводимых пятен с тканей и даже для удаления накипи в чайнике.
Меры предосторожности
Так как реагент имеет сильную разъедающую способность и при взаимодействии с воздухом выделяет токсичные пары, при работе с ним очень важно использовать защитные средства.
При попадании на кожные покровы и слизистые оболочки материал вызывает химические ожоги, а при продолжительном нахождении в атмосфере HCl происходит разрушение зубов, развитие катара дыхательных путей и изъязвление слизистой оболочки носа.
В целях защиты необходимо использовать противогаз, прорезиненный фартук, очки и резиновые перчатки. Работы проводить только в хорошо проветриваемых помещениях. При попадании реагента на кожу или слизистые промыть пораженный участок большим количеством проточной воды и обратиться за медицинской помощью.
Как избавиться от засоров?
Для жесткой и целенаправленной очистки канализации от органических отложений (жиров, остатков еды, волос, моющих средств и пр.) следует использовать разбавленную соляную кислоту. Этот способ не подходит для стальных, железных и пластмассовых труб, так как соединение может привести к их коррозии и даже образованию сквозных дыр.
Перед началом проведения процедуры нужно закрыть сливные отверстия в другой сантехнике и обеспечить приток воздуха в помещение. Этот шаг необходим, так как в процессе работы кислота начнет активно вырабатывать токсичные газы.
Рекомендуется развести состав водой до достижения 3-10 % концентрации, после чего залить непосредственно в канализацию и оставить на 1-2 часа. Затем нужно промыть трубы большим количеством воды и при необходимости провести процедуру повторно.
Важный момент! Не следует смешивать реагент с другими средствами для прочистки канализации, особенно на основе щелочей. В противном случае реакция этих соединений приведет к сильному повреждению труб.
Другое применение кислоты в быту
Кислотным составом можно легко очистить сантехнику из фаянса от известкового налета и ржавчины, удалить мочевой камень и другие загрязнения. Для большего эффекта к средству добавляют ингибитор (например, уротропин), замедляющий химическую реакцию.
Процедуру проводят следующим образом: кислоту разбавляют водой до достижения 5 %-ной концентрации и добавляют ингибитор из расчета 0,5 г на 1 л жидкости. Полученным составом обрабатывают поверхность и оставляют на 30-40 минут (в зависимости от степени загрязнения), после чего промывают водой.
Слабый кислотный раствор также используется для удаления пятен от ягод, чернил или ржавчины с тканей. Для этого материал замачивают в составе на некоторое время, после чего тщательно ополаскивают и стирают в обычном режиме.
Избавление от накипи в чайнике
Для этой цели используют 3-5 %-ный раствор соляной кислоты, который наливают в чайник и нагревают до 60-80°С в течение 1-2 часов или до тех пор, пока накипные отложения не распадутся. После этого накипь становится рыхлой и легко удаляется деревянной лопаточкой.
Эффективность метода обусловлена тем, что реагент вступает в реакцию с карбонатами магния и кальция и превращает их в растворимые соли. Выделяющийся при этом углекислый газ разрушает слой накипи и придает ему рыхлость. После удаления солевых отложений посуду тщательно моют чистой водой.
Важный момент! Этот способ не подходит для удаления накипи в эмалированных или алюминиевых чайниках со сколами и трещинами: это приведет к коррозии металла и его сильному повреждению.
Вывод
При соблюдении мер предосторожности и правил безопасности соляная кислота станет незаменимым помощником в быту. А приобрести ее по самым доступным ценам можно в нашей компании.
Источник: https://him-kazan.ru/stati/solyanaya-kislota-primenenie-v-byitu-dlya-prochistki-trub
Травление металла
Травление – это процесс очистки и обработки металлической заготовки. Химическое, кислотное, щелочное, электрохимическое – есть много способов выполнения этой технологической операции. Где применяют травление металла, зачем его используют в промышленности, какие бывают способы обработки с применением этой технологии, всё эти вопросы подробно разобраны в представленной ниже статье.
Что такое травление
Это технология удаления верхнего слоя с поверхности металлической детали. Технология применяется для очистки заготовок от окалины, ржавчины, окислов и снятия верхнего слоя металла. Используя этот способ, снимают верхний слой для поиска внутренних дефектов и изучения макроструктуры материала.
С помощью травления зачищают деталь и увеличивают адгезию поверхности. Это делают для последующего соединения металлической поверхности с другой заготовкой, перед нанесением краски, эмали, гальванического покрытия и других защитных покрытий.
Метод позволяет не только быстро очистить деталь, но и создать на металлической поверхности нужный рисунок. Этим методом вырезают на металлической поверхности тончайшие каналы и сложные изображения. Можно выполнять очистку габаритных деталей или проката. Глубина обработки регулируется с точностью до несколько микрон, что позволяет изготавливать сложные детали с небольшими пазами и другими сложными элементами.
Применение травления в промышленности
- Для очистки от оксидной плёнки деталей из углеродистой, низколегированной и высоколегированной стали, титана и алюминия.
- Для улучшения адгезии перед нанесением гальванических и других видов защитных покрытий.
- Для подготовки стальной поверхности к горячему цинкованию.
- Чтобы провести макроанализ для выявления образования межкристаллитной коррозии у нержавеющих сталей.
- С помощью этой технологии обрабатываются мелкие металлические детали, такие как шестерёнки наручных часов.
- Обработка меди применяется для изготовления полупроводниковых микросхем и печатных плат в электронике.
Этим методом выполняется нанесение токопроводящего рисунка на микросхему.
- Для быстрой очистки изделий горячего металлопроката, термообработанных деталей, от окислов.
- В авиастроении с помощью этой технологии уменьшают толщину алюминиевых листов для снижения массы самолёта.
- При изготовлении металлических надписей и рисунков.
Травлением получают рельефные изображения, нарисованные путём удаления слоя металла по определённому трафарету.
Виды травления
Основные разновидности применяемой в промышленности обработки металлов:
- электролитическое – бывает катодное и анодное;
- химическое;
- плазменное.
Электролитическое травление
Электролитическая или гальваническая обработка металла применяется для быстрой очистки деталей, нанесения гравировок и получения пазов. Металлические детали погружают в кислотный или солевой электролит. Деталь становится катодом – отрицательным электродом или анодом – положительным электродом. Поэтому классифицируют два типа электролитического травления – катодное и анодное.
- Катодное травление. Метод применяется для снятия окалины с поверхности изделий из углеродистых сталей после горячей прокатки или проведения закалки в масле. При катодном травлении материалом для анода служит свинец, электролитом является раствор соляной, серной кислоты или соли щелочного металла. В процессе электролиза на катоде активно выделяется газообразный водород, который взаимодействует с железом, и отрывает окалину. Металлическая поверхность при катодном методе активно насыщается водородом, что повышает хрупкость заготовки. Поэтому для тонкостенных изделий катодный способ не применяют.
- Анодная электрохимическая очистка. Это самый распространённый в машиностроении способ. Процесс заключается в механическом отрывании на аноде оксидной плёнки кислородом и смешивании с электролитом металлических молекул. Электролит представляет собой раствор кислот или солей обрабатываемого металла. В качестве катода применяют свинец, медь и другие металлы. При анодной обработке поверхность изделий становится чистой, с небольшой шероховатостью, а металл растворяется в электролите. При этом способе существует риск уменьшения толщины заготовки и перетравливания.
Химическое травление
Метод химической обработки используют для очистки поверхности детали от оксидной плёнки, окалины и ржавчины для заготовок из следующих материалов:
- чёрных металлов;
- нержавеющих и жаропрочных сталей;
- титана и его сплавов;
- алюминия.
Для травления применяют серную, соляную или азотную кислоту. Заготовку погружают в кислотный или щелочной раствор, расплав соли и выдерживают на протяжении нужного временного интервала. Необходимое время для очистки может составлять от 1 до 120 минут.
Процесс очистки происходит за счёт выделения водорода при взаимодействии кислоты с металлом. Молекулы кислоты проникают через поры и трещины под оксидную плёнку. Там они взаимодействуют с металлической поверхностью, выделяется водород. Выделяющийся газ отрывает оксидную плёнку и очищает деталь.
Одновременно с оксидами в кислоте растворяется обрабатываемый металл. Чтобы предотвратить этот процесс используются ингибиторы коррозии.
Плазменное травление
При ионно-плазменном способе очистка и снятие поверхностного слоя происходит путём бомбардировки детали ионами инертных газов, которые не вступают в химическую реакцию с молекулами обрабатываемого материала. Позволяет делать высокоточные насечки, пазы с точностью до 10 нм. Технология применяется в микроэлектронике.
Плазмохимический метод предусматривает возбуждение плазмы в химически активной среде, что вызывает образование ионов и радикалов. Активные частицы, попадая на металлическую поверхность, вызывают химическую реакцию. При этом образуются лёгкие соединения, которые удаляются из окружающей воздушной среды вакуумными насосами.
Метод основывается на химических реакциях, возникающих при использовании химически активных газов, таких как кислород, обладающих большой реакционной способностью. Эти газы активно взаимодействуют в плазме газового разряда. В отличие от плазменной обработки в инертных газах при этом способе очистки активный газ вступает в реакцию только с определёнными молекулами.
Недостатком этого метода является боковое расширение пазов.
Травители
Травление углеродистых сталей осуществляется в 8-20% растворе серной или 10-20% соляной кислоты. С обязательным добавлением ингибиторов коррозии (КС, ЧМ, УНИКОЛ) для устранения хрупкости материала и уменьшения возможности перетравливания.
Изделия из нержавеющей или жаропрочной стали обрабатываются с применением раствора, состоящего из: 12% соляной, 12% серной, 1% азотной кислоты. Если требуется, обработку делают в несколько ступеней. Первая – в 20% соляной кислоте разрыхляется окалина. Второй этап – это погружение в 20-40% раствор азотной кислоты для полного удаления поверхностных загрязнений.
Толстый слой окалины, который образуется на нержавеющей стали, при её производстве удаляют 75-85% расплавом едкого натра с 20-25% азотнокислого натрия. После чего в 15-20% азотной кислоте производится полное удаление окислов.
Обработку алюминия и сплавов на его основе используют снятия тугоплавкой оксидной плёнки с поверхности заготовки. Для этого применяются щелочные или кислотные растворы. Обычно используют 10-20 % щёлочь, при температуре 50-80 ºС, процедура травления занимает менее 2 минут. Добавка в щелочь хлористого и фтористого натрия делает этот процесс более равномерным.
Очистка титана и его сплавов, проводимая после термической обработки, выполняется в несколько этапов. На первой стадии в концентрированном едком натре разрыхляют окалину. Затем удаляют окалину в растворе из серной, азотной или фтористоводородной кислоты. Для удаления оставшегося травильного шлама используют соляную или азотную кислоту с добавкой небольшого количества фтористоводородной кислоты.
При обработке меди и ее сплавов используют травители из перекиси водорода, хромовой кислоты и следующих солей:
- хлорида меди;
- хлорида железа;
- персульфата аммония.
Этот информационный материал подробно описывает применяемый на металлургических предприятиях процесс травления. Способ позволяет быстро очищать поверхность металла от окислов, окалины, ржавчины и других загрязнений. Благодаря травлению можно наносить на металл различные рисунки, создавать сложные микросхемы и делать микроскопические каналы нужной формы.
Источник: https://prompriem.ru/stati/travlenie-metalla.html
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
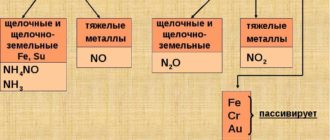
- Соляная кислота — неорганическое вещество, одноосновная кислота, одна из самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман. Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.— Обрабатывают кожу перед дублением.— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Источник: https://pcgroup.ru/blog/solyanaya-kislota-odna-iz-samyh-silnyh-kislot-chrezvychajno-vostrebovannyj-reaktiv/
Травление поверхности. Часть 1
При изготовлении и хранении металлические изделия подвергаются воздействию окружающей среды, в результате их поверхность покрывается продуктами коррозии или термической окалины. Этот слой не только ухудшает внешний вид изделий, но и затрудняет выполнение последующих технологических операций.
Перед осаждением на изделия гальванических покрытий их поверхность должна быть очищена от всяческих загрязнений и окислов. Загрязнения удаляются в процессе обезжиривания (см. «Обезжиривание поверхности.»). От окислов и термической окалины поверхность очищается в процессе травления.
Травление может осуществляться в растворах химическим или электрохимическим способом
Гальваническая линия для травления поверхности
Химическое травление проводят путем погружения изделий в травильный раствор без воздействия электрического тока.
Наибольший процент деталей, покрываемых в гальваническом цехе, из низкоуглеродистой стали, которые имеют на поверхности окисный слой, неравномерный по толщине. Слой окалины пористый, поэтому при травлении в растворах кислот вместе с окислами происходит частичное растворение металла.
Для травления окисла двухвалентного железа используют в основном растворы серной и соляной кислот. Необходимо процесс травления осуществлять таким образом, чтобы травление в растворе основного металла было минимальным. Это зависит от состава раствора, концентрации кислот и температуры.
В растворе соляной кислоте, в отличие от серной, травление окалины происходит за счет ее химического растворения. На практике используют 10 – 20 % растворы соляной кислоты при комнатной температуре. При травлении в растворе серной кислоты оптимальная концентрация 20 – 25%, температура 50 – 600С. Учитывая различный характер воздействия кислот на железо и его окислы, для травления применяют смеси растворов: серной кислоты – 5%, соляной – 15% или серной 10%, соляной – 10%.
Процесс травления, кроме удаления окалины, сопровождается выделением водорода, при этом в растворе происходит наводораживание поверхности, приводящее к охрупчиванию. Для предотвращения сорбции металлом водорода в травильные растворы вводят ингибиторы: катапин К-И-1, синтанол, уротропин и др. в количестве 3 – 5 г/л.
При травлении в растворах легированных сталей, ввиду наличия термической окалины, требуется применение более активных растворов. Целесообразно проводить травление в растворах в две стадии: разрыхлить основной слой окалины в растворе 20% — ной соляной или серной кислоте, а закончить травление в растворе 20 – 40%-ной азотной кислоте.
Для ускорения процесса очистки поверхности применяют электрохимический метод травления, который можно проводить как на аноде, так и на катоде
При анодном травлении сначала происходит травление в растворе оксидной пленки, а затем образование пассивной пленки. Процесс травления протекает интенсивно, поэтому важно не перетравить поверхность детали, которая является анодом. Анодное травление применяется для деталей простой формы из углеродистой и легированной стали.
Составы растворов электролитов для анодного травления углеродистых сталей, г/л:
Раствор 1:
Серная кислота 200 – 250Железо сернокислое 7-ми водное 1 – 2Натрий хлористый 20 – 25
Температура раствора 40 – 500С, ДА= 5 – 10 А/дм2 , время 10 – 20 минут
Раствор 2:
Соляная кислота 8 – 10Натрий хлористый 40 – 50Железо хлористое 6-ти водное 140 – 150
Температура раствора 18 – 350С, ДА= 5 – 10 А/дм2 , время 5 – 10 минут
Плотность анодного тока выбирается в зависимости от состояния поверхности при травлении в растворе электролита и от требуемой скорости процесса.
Составы растворов электролитов для катодного травления углеродистых сталей, г/л:
Раствор 1:
Серная кислота 100 – 150
Температура раствора 40 – 500С, ДК= 3 – 10 А/дм2, время 10 – 15 минут.
Раствор 2:
Серная кислота 50 – 60Соляная кислота 25 – 30Натрий хлористый 15 – 20
Температура раствора 60 – 700С, ДА= 10 – 15 А/дм2 , время 10 – 15 минут
Катодное травление в растворе электролита применяется главным образом для удаления оксидов с поверхности деталей, подвергнутых термической обработке и закалке в масле. В качестве анода используется свинец.
В случае затруднений при очистке поверхности – обращайтесь за услугами к нам.
Внимание! Учебный курс по гальванике! Узнать подробнее
Запись опубликована в рубрике В помощь технологам. Добавьте в закладки постоянную ссылку.
Источник: http://blog.tep-nn.ru/?p=1644
Коррозия цинка
Коррозия цинка – разрушение металла под воздействием агрессивной коррозионной среды.
Для процесса Zn2+ + 2e → Zn стандартный электродный потенциал цинка составляет -0,76 В.
Температура плавления цинка — 419,6 °C.
Плотность цинка — 7,133 г/см2.
Коррозия цинка может проходить как с водородной, так и кислородной деполяризацией.
Максимальная устойчивость цинка и цинковых покрытий отмечается в интервале рН 9 – 11. При более низких или высоких значениях коррозия цинка значительно увеличивается.
Коррозия цинка в воде
Коррозия цинка в воде наблюдается при температуре выше 55 °C. С повышением температуры скорость коррозии увеличивается, максимум наблюдается при температуре 70 °C. После этого разрушение металла проходит очень медленно. Это связано с образованием в воде на поверхности цинка продуктов коррозии.
При температурах до 55 °C и выше 90 – 95 °C продукты коррозии обладают достаточно высокими защитными свойствами, образуя на поверхности плотную сплошную пленку. Максимальная скорость коррозии цинка объясняется образованием рыхлой пленки, состоящей с Zn(OH)2, которая не имеет хороших защитных свойств, т.к.
легко отслаивается.
В нейтральных растворах коррозия цинка проходит с кислородной деполяризацией.
В морской воде цинковое покрытие стали можно назвать достаточно эффективным. За год расходуется около 0,03 мм цинка. Срок службы цинкового покрытия, толщиной 0,13 мм составляет около 4 – 5 лет, что достаточно много для такой агрессивной среды. Для алюминия и его сплавов, находящихся в морской воде, цинк является протектором.
Для уменьшения скорости коррозии цинка в водной среде применяют следующие ингибиторы: кремненатриевую и двухромовонатриевую соль, гексаметафосфат натрия, ланолин, буру.
Атмосферная коррозия цинка
Коррозия цинка в атмосферных условиях не протекает. Это связано с образованием на поверхности тонкой защитной пленки основного оксида цинка – ZnO. Достаточно высокой коррозионной стойкостью отличается цинк, находясь и в морской атмосфере. Поверхность покрывается гидроксидом цинка и его основными углекислыми солями. Находясь в морской атмосфере цинковое покрытие, толщиной 0, 03 мм хорошо защищает поверхность изделия на протяжении восьми лет.
Промышленная атмосфера (с примесями SO2, SO3, HCl) негативно сказывается на коррозионную стойкость цинка. Срок службы цинкового покрытия такой же толщины ограничивается четырьмя годами. Сельская атмосфера особого негативного влияния не оказывает, срок службы – около 11 лет.
Коррозия цинка в кислотах
Как цинк обычной чистоты, так и его оксид корродируют при контакте с кислотами. Очень чистый цинк с растворами кислот и щелочей не реагирует даже при повышении температуры. Реакция начинается только при добавлении сульфата меди (CuSO4). Коррозия цинка также наблюдается в растворах щелочных, кислых солей.
В кислотах и подкисленных средах коррозия цинка проходит с водородной деполяризацией, т.е. выделением водорода.
Коррозия цинка в соляной кислоте протекает интенсивно, с образованием хлорида цинка и выделением водорода по реакции:
Zn + 2HCl → ZnCl2 + H2.
Одним из направлений применения соляной кислоты является именно получение хлорида цинка.
Коррозия цинка в серной кислоте также протекает довольно интенсивно, с образованием сульфата цинка и выделением водорода по реакции:
Zn + H2SO4(разб.) → ZnSO4 + H2.
Коррозия цинка в щелочах
Цинк активно реагирует со щелочами, образую гидроксоцинкаты.
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H.
Интенсивно проходит коррозия цинка при контакте с раствором аммиака:
Zn + 4NH3•H2O → [Zn(NH3)4](OH)2 + 2H2O + H2
При этом образуется аммиачный комплекс [Zn(NH3)4](OH)2.
При контакте цинка с металлом, имеющим более электроположительный потенциал, скорость коррозии цинка значительно возрастает. Цинк используют как протектор для более благородных металлов.
Хотя цинк и является достаточно коррозионностойким металлом – он не нашел применения в пищевой промышленности, т.к. при контакте с кислыми пищевыми продуктами образует токсичные соли.
Источник: https://www.okorrozii.com/korrozia-zinka.html
Рецепты паяльной кислоты
При проведении пайки для предварительной обработки поверхности деталей во многих случаях используют флюсы кислотного характера. Степень активности материала подбирают в зависимости от типа металла и меры его загрязнения.
В продаже есть различные средства, состав которых подобран с учетом специфики предстоящей работы. Можно сделать паяльную кислоту в домашних условиях самостоятельно.
Для этого потребуется определенные знания, элементарное умение делать химические составы и небольшая сумма денег для приобретения компонентов.
Зачем нужен кислотный флюс
К металлам относятся вещества большой активности. Многие из них легко и быстро окисляются в присутствии воздуха. Образующиеся оксиды под действием атмосферной влаги превращаются в гидроксиды.
Смесь продуктов окисления хорошо заметна на железных изделиях после хранения на воздухе. Называется она ржавчиной. Другие металлы также покрываются оксидным слоем, который не позволяет ничего припаять к изделию.
Справиться с проблемой помогают кислотные флюсы, самым простым их которых является паяльная кислота. Под этим названием собраны несколько разных однокомпонентных или сложных составов, многие из которых можно приготовить своими руками.
Что можно сделать дома
Степень кислотности флюсов отличается. К активным смесям относятся композиции с хлоридом цинка. Из школьного курса, возможно, кто-то запомнил свойства солевых растворов.
Соли в присутствии воды склонны претерпевать гидролиз. Хлорид цинка при обменных реакциях с водой образует сильную кислоту и слабую щелочь. Поэтому раствор имеет активный кислотный характер. Соляная кислота быстро удаляет оксидные вещества.
Обычно паяльную кислоту делают прибавлением 412 г цинка к 1 литру концентрированной соляной (гидрохлоридной) кислоты. Процедура это не совсем приятна и безопасна. При работе выделяются летучие кислые пары.
Работать с концентрированной солянкой следует только под вытяжкой или в респираторе, находясь в хорошо проветриваемой комнате.
С соляной кислотой
Популярностью пользуется несколько составов с хлористым цинком. Соединения цинка используются в процессе цинкования для защиты металлов от коррозии. Этот химический элемент известен устойчивостью к процессам окисления. Сделать паяльные кислоты своими руками несложно.
Для продукции из черных и цветных металлов подойдет следующее соотношение:
- хлорид цинка – минимум 25 %, максимум – 30 %;
- концентрированная соляная кислота – 0,7 %.
Оба компонента нужно быстро растворить в воде. Следует учесть, что соляная кислота – сильно летучее вещества. Работать с ней желательно под вытяжкой. Склянку с исходным реактивом нужно держать только в закрытом состоянии.
С вазелином и спиртом
Для деталей из черных и цветных металлов иногда вместо паяльной кислоты удобнее использовать пасту с кислотными свойствами.
Для ее приготовления нужно смешать насыщенный раствор хлорида цинка – 3,7 % и технический вазелин – 85 %. Для придания требуемой консистенции в смесь добавляют немного воды.
Для работы с никелем, платиной и их сплавами своими руками можно сделать паяльную смесь из хлорида цинка – 1,4 % и этилового (винного) спирта – 40 %. Оба компонента нужно тщательно растворить в воде и перемешать готовый паяльный раствор.
После пользования всеми приведенными составами паяльную зону нужно хорошо промыть обычной водой.
С канифолью
Для проведения ответственных работы с черными металлами, пайки драгоценных и цветных металлов подойдет пастообразная смесь, сделанная своими руками из канифоли – 24 % и хлорида цинка – 1 %. Все это нужно растворить в этиловом спирте. Промывать рабочую зону по окончании паяльной процедуры нужно ацетоном.
Для образования шва с повышенными прочностными характеристиками рекомендуется взять:
- канифоли – 16 %,
- хлорида цинка – 4 %,
- технического вазелина – 80 %.
Промывать место пайки после обработки такой паяльной пастой, сделанной своими руками, сложнее. Взять нужно ацетон.
Как показывает опыт, в некоторых случаях имеет смысл заменить паяльную кислоту соответствующей пастой кислотного характера.
Самодельные кислые пасты
При работе с алюминиевыми деталями часто используют флюс с олеиновой кислотой, формула которой С17Н33СООН дает представление о большой молекулярной массе. Высшая кислота имеет вязкую консистенцию, похожа на слегка тягучую жидкость.
Паяльный флюс делается следующим образом: 20 мл олеиновой кислоты, около 3 г йодида лития растворяют в стеклянной емкости на водяной бане. Однородный раствор, сделанный своими руками, после остывания переливают в стеклянный флакон для хранения.
После пайки рабочую зону промывают ацетоном, бензином или спиртом.
Для пайки нихрома можно своими руками сделать состав из 100 г вазелина, 7 г порошкообразного хлорида цинка, 7 г глицерина.
Всю массу нужно хорошо перемешать. Желательно это сделать в толстой фарфоровой чашке или специальной ступке.
Другие доступные варианты
Широко используется для обработки железных, стальных, никелевых сплавов ортофосфорная кислота. Часто ее называют просто фосфорной. Этой кислотой можно обрабатывать поверхность чистой меди.
На всех металлах фосфорная кислота не только удаляет оксиды, но и образует защитный слой.
При паяльных работах верхний слой фосфатов легко разрушается разогретым жалом паяльника. На обработанных деталях равномерно распределяется припойная масса. В результате получается прочное соединение.
Самым, пожалуй, простым вариантом замены паяльной кислоты является обычный аспирин. Раствор быстро готовится своими руками. Нужно взять обычную дешевую таблетку, растворить в небольшом количестве воды. Иногда мастера просто посыпают растолченным аспирином место пайки.
В продаже есть готовый флюс ВТС, который, по сути, также является паяльной кислотой. Аналогичное средство можно сделать своими руками.
Нужно взять салициловую кислоту, вазелин, триэтаноламин. Растворить все компоненты в спирте. Флюс успешно используется для работы с медью, платиной, серебром и их сплавами.
Источник: https://svaring.com/soldering/flus/recepty-pajalnoj-kisloty
Паяльная кислота своими руками
Паяльная кислота является тем флюсом, который можно отнести к отдельной категории, ведь он влияет агрессивно на материалы, которые необходимы при работе. Этот флюс в основном распространяется в жидком состоянии, причем это не зависит от его концентрации. Иногда можно приобрести концентрированное вещество, а потом разбавить его, а возможно и купить уже готовое, разбавленное. Кроме этого каждый вполне может сделать паяльную кислоту самостоятельно.
Свойства материалов необходимо подбирать по тем факторам, которые необходимы для их применения.
Кислота для спаивания предназначается для тех металлов, которые имеют сильные загрязнения, ведь на них происходит окисление, а также на поверхности остается большое количество ржавчины.
Материал очень активен, поэтому необходимо работать с ним осторожно и избегать попадания на кожные покровы и слизистые оболочки человека. Необходимо сначала внимательно ознакомиться с правилами и методами применения кислоты, а уже потом начинать применять ее по назначению.
В процессе производства паяльной кислоты самостоятельно, необходимо использовать специальную технологию. В конце должен получиться тот материал, который будет иметь те свойства, предписанные ГОСТом. Именно это сделает флюс качественным и надежным, чтобы соединения были прочными.
Необходимо сделать так, чтобы свойства и функции кислоты работали и после спаивания металлов, ведь материл убирает пленки и ржавчину с поверхности, а также препятствует их повторному возникновению.
Следует также учитывать растекаемость по поверхности спаиваемых материалов и схватываемость с металлами и изделиями.