Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
В природе алюминий встречается в виде минералов:
- Al2O3 — корунд
- 3BeO*Al2O3*6SiO2 — берилл (аквамарин — примесь Fe и изумруд — примесь Cr2O3)
- Al2O3*Cr2O3 — красный рубин
- Al2O3 с примесью Fe+2/Fe+3/Ti
- Al2O3*H2O — боксит
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3AlF6). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Al2O3 → (t) Al + O2 (в расплаве криолита — Na3AlF6)
- Реакции с неметаллами
- Реакции с кислотами и щелочами
- Реакция с водой
- Алюминотермия
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой — Al2O3)Al + Br2 → AlBr3 (бромид алюминия)При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.Al + F2 → (t) AlF3 (фторид алюминия)Al + S → (t) Al2S3 (сульфид алюминия)Al + N2 → (t) AlN (нитрид алюминия)Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.Al + HCl → AlCl3 + H2Al + H2SO4(разб.) → Al2(SO4)3 + H2Al + H2SO4(конц.) → Al2(SO4)3 + SO2 + H2OAl + HNO3(разб.) → Al(NO3)3 + N 2O + H2OAl + NaOH + H2O → Na[Al(OH)4] + H2 (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)При прокаливании комплексные соли не образуются, так вода испаряется:Na[Al(OH)4] → NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.Al + H2O → Al(OH)3 + H2
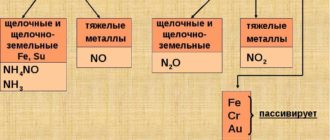
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.Fe2O3 + Al → Al2O3 + FeCr2O3 + Al → Al2O3 + CrMnO2 + Al → Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.Al + O2 → Al2O3Al(OH)3 → (t) Al2O3 + H2OПроявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.Al2O3 + H2SO4 → Al2(SO4)3 + H2OAl2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.AlBr3 + LiOH → Al(OH)3↓ + LiBrAl(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 — по аниону)Al2S3 + H2O → Al(OH)3↓ + H2SПроявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.Al(OH)3 + H2SO4 → Al2(SO4)3 + H2OAl(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
Источник: https://studarium.ru/article/165
Важнейшие природы соединения алюминия
Al2O3·2SiO2·2H2O
Каолинит- минерал подклассаслоистых силикатов,главная составнаячасть белой,огнеупорной,и фарфоровойглины. Обычноявляется продуктомвыветривания.Имеет две полиморфныемодификации- диккит и накрит.Каолинит сильногигроскопичен.
Бокситы:
Al2O3·nH2O
Бокситыэто осадочныеалюминиевыеруды. Содержатвредную примесь- SiO2.Бокситыслужат важнымсырьем дляполученияалюминия, атакже красок,абразивов иогнеупорныхматериалов.
Корунд:
Al2O3
Корундотносится кклассу простыхоксидов, и иногдаобразует прозрачныедрагоценныекристаллы -сапфира, и, сдобавлениемхрома, рубина.Накапливаетсяв россыпях. Восновном используетсякак абразивныйматериал. Егосмесь с магнетитом,гематитом, ишпинелью называютнаждаком.Синтетическийкорунд с различнымидобавкамиполучают впромышленныхмасштабах дляквантовойэлектроники,часовой, ювелирнойи другой промышленности.
Нефелин:
Na2O·Al2O·2SiO2
Минерал- серые, красноватыеи другие кристаллыс характернымжирным блеском.Главный минералщелочных изверженныхпород. Используетсякак сырье длядобычи алюминияс попутнымполучениемсоды.
Полевойшпат или ортоклаз:
K2O·Al2O3·6SiO2
Калиевыйполевой шпат.Белый, серый,розовый, и.т.д.Одна из главныхсоставныхчастей гранитов,гнейсов, и другихизверженныхи метаморфическихпород. Сырьестекольнойи керамическойпромышленности.
Варнавский
Важнейшиесоединенияалюминия.
Внешнийвид:
Оксидалюминия — твердое,тугоплавкоевещество белогоцвета.Можетобразовыватьпрозрачныекристаллысапфира или,с добавлениемхрома, рубина.
Получение:
Оксидалюминия получаютнепосредственнопутем сжиганияпорошка металлическогоалюминия, вдуваниемего в пламягорелки:
Химическиесвойства:
Al2O3- амфотерныйоксид. Он реагируетс кислотами:
Al2O3+ 6HCl 2AlCl3+ 3H2O
ис щелочами:
Al2O3+ 2NaOH 2NaAlO2+ H2O
нов присутствииводы реакцияпротекаетиначе:
Al2O3+ 2NaOH +H2O 2[NaAlO2·H2O]
Этообъясняетсятем, что в водеиллюминатнатрия (NaAlO2)можетприсоединитьодну или двемолекулы воды:NaH2AlO3илиNaAlO2.
Внешнийвид:
Еслибелую желеобразнуюмассу выделитьиз раствора,а затем высушить,то получитсябелое кристаллическоевещество, практическине растворяющеесяв воде.
Получение:
Гидроксидалюминия получаютпри взаимодействиираствора щелочис растворамисолей алюминия.При этом растворщелочи нельзябрать в избытке.
AlCl3+ 3NaOH Al(OH)3+ 3NaCl
Алюминий в природе (7,5% в Земной коре)
Алюминий был выделен в ходе эксперимента по воздействию калиевых соединений ртути на природные бокситы. Учитывая всю сложность процесса, алюминий на протяжении нескольких десятилетий оставался самым дорогим металлом на земле.
Научные изыскания привели к открытию относительно дешевого способа получения алюминия по методу поэтапного электролиза с дальнейшей очисткой и осаждением металла. Повсеместное распространение этого метода позволило получать чистый алюминий в промышленных масштабах. Текущие показатели среднесуточного производства этого металла превышают 130 тысяч тонн.
Основные характеристики
Легкий парамагнитный металл серебристого цвета с мутноватой поверхностью. Хорошо поддается формовке и ковке, практически не подвержен коррозии. На открытом воздухе покрывается естественным защитных слоем из окислов, что предотвращает дальнейшие реакции между алюминием и атмосферным кислородом. Имеет относительно малую прочность на излом, быстро накапливает усталость, что ограничивает его использование в чистом виде.
Хорошо проводит электричество и тепловую энергию, уступая по этим показателям лишь меди и металлам платиновой подгруппы. Относительная дешевизна алюминия обеспечили ему широкое распространение в качестве конструкционного металла и универсального диэлектрика.
Физические свойства
Металл пластичный, со сравнительно низкой плотностью при высоких конструкционных показателях (высокая тепло- и электропроводимость, устойчивость к коррозионному воздействию). Основные физические свойства алюминия можно выделить в виде следующего списка:
- Плотность — 2,7 г/см3;
- Температура плавления — 659 0С;
- Коэффициент пластичности — 50%;
- Коэффициент электропроводности — 32*106 См/м;
- Средний показатель теплопроводности — 204 Вт/м;
В отличие от таких металлов, как свинец или медь, при нагревании до отметки в 600 градусов Цельсия алюминий становится хрупким, разбивается на отдельные гранулы или зерна. Отлично проводит тепло, легко нагревается и также легко остывает без каких-либо последствий для кристаллической решетки металла.
Алюминий — довольно активный метал, легко сплавляется с другими металлами и неметаллами, образуя равномерную кристаллическую решетку с высокими конструктивными качествами.
Химические свойства
Химически активный амфотерный элемент:
- Реагирует с хлором, бромом и другими галогенами, образуя соответствующие соли;
- Вступает в реакции с неметаллами;
- Растворяется в сильных кислотах;
- Обладает свойством восстанавливать другие металлы, что используется при очистке железа и хрома;
Все вышеперечисленные реакции требуют наличия дополнительных катализаторов и проводятся при нагревании.
алюминия в природе
Относительное содержание алюминия определено в пределах от 7% до 8% (в среднем — 7,5% по массе). Количественная оценка включает в себя все минералы и соли алюминия. Металл входит в состав огромного количества природных соединений. Основным промышленным сырьем для получения чистого алюминия являются бокситы, алюмосиликаты и другие природные минералы, содержащие оксид алюминия.
Сфера применения
Сочетание низкой стоимости, устойчивости к коррозии и высокой реактивной способности вывели алюминий в лидеры среди всех металлов, используемых современной промышленностью. Алюминий — самая распространенная легирующая добавка для изготовления сплавов на основе меди, магния, титана и никеля. Повышает показатели упругости и прочности, придает сплаву антикоррозионные свойства.
Алюминий несильно уступает меди по электропроводности, при этом имеет в 4-5 раз меньшую стоимость и значительно более легкий процесс очистки, что объясняет его распространение для изготовления проводниковых элементов, конденсаторов и электронных компонентов.
Также алюминий используется в качестве химического катализатора (в составе комбинированных соединений), при производстве зеркал и взрывчатых веществ. Нейтральность алюминия позволяет использовать его в пищевой промышленности для изготовления упаковочных материалов и посуды.
Источник: https://xn----8sbiecm6bhdx8i.xn--p1ai/%D0%B0%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D0%B9.html
Алюминий, свойства, сплавы, производство — Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)
Алюминий — химический элемент III группы периодической системы Менделеева (атомный номер 13, атомная масса 26,98154). В большинстве соединений алюминий трехвалентен, но при высоких температурах он способен проявлять и степень окисления +1. Из соединений этого металла самое важное — оксид Al2O3.
Алюминий — серебристый-белый металл, легкий (плотность 2,7 г/см3) , пластичный, хороший проводник электричества и тепла, температура плавления 660 °C. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления.
Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия.
- Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона:
- Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] .
- Алюминий, лишенный защитной пленки, взаимодействуют с водой, вытесняя из нее водород:
- 2Al + 6H2O = 2Al(OH)3 + 3H2
- Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
- Al(OH)3 + NaOH = Na[Al(OH)4].
- Суммарное уравнение растворения алюминия в водном растворе щелочи имеет следующий вид:
- 2Al + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2.
- Алюминий активно взаимодействует и с галогенами. Гидроксид алюминия Al(OH)3 — белое, полупрозрачное, студенистое вещество.
- В земной коре содержится 8,8% алюминия. Это третий по распространенности в природе элемент после кислорода и кремния и первый — среди металлов. Он входит в состав глин, полевых шпатов, слюд. Известно несколько сотен минералов Al (алюмосиликаты, бокситы, алуниты и другие). Важнейший минерал алюминия — боксит содержит 28-60% глинозема — оксида алюминия Al2O3.
В чистом виде алюминий впервые был получен датским физиком Х. Эрстедом в 1825 году, хотя и является самым распространенным металлом в природе. Производство алюминия осуществляется электролизом глинозема Al2O3 в расплаве криолита NaAlF4 при температуре 950 °C.
Алюминий применяется в авиации, строительстве, преимущественно в виде сплавов алюминия с другими металлами, электротехнике (заменитель меди при изготовлении кабелей и т.д.), пищевой промышленности (фольга), металлургии (легирующая добавка), алюмотермии и т.д.
Плотность алюминия, удельный вес и другие характеристики
- Плотность — 2,7*103кг/м3;
- Удельный вес — 2,7 г/cм3;
- Удельная теплоемкость при 20°C — 0,21 кал/град;
- Температура плавления — 658,7°C ;
- Удельная теплоемкость плавления — 76,8 кал/град;
- Температура кипения — 2000°C ;
- Относительное изменение объема при плавлении (ΔV/V) — 6,6%;
- Коэффициент линейного расширения (при температуре около 20°C) : — 22,9 *106(1/град);
- Коэффициент теплопроводности алюминия — 180 ккал/м*час*град;
Модули упругости алюминия и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
| Алюминиевая бронза, литье | 10500 | 4200 | — |
| Алюминиевая проволока тянутая | 7000 | — | — |
| Алюминий катаный | 6900 | 2600-2700 | 0,32-0,36 |
Отражение света алюминием
Числа, приведенные в таблице, показывают, какая доля света в %, падающего перпендикулярно к поверхности, отражается от нее.
| Наименование волн | Длина волны | Отражение света, % |
| Ультрафиолетовые | 1880 2000 2510 30503570 | 25 31 53 6470 |
| Видимые | 5000 60007000 | — — |
| Инфакрасные | 8000 10000 50000100000 | — 74 9497 |
ОКСИД АЛЮМИНИЯ Al2O3
Оксид алюминия Al2O3, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные в красный или синий цвет, представляют собой драгоценные камни — рубин и сапфир.
В настоящее время рубины получают искусственно, сплавляя с глиноземом в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п.
Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов — лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей — наждак, применяются как абразивные материалы.
ПРОИЗВОДСТВО АЛЮМИНИЯ
Основным сырьем для производства алюминия служат бокситы, содержащие 32-60% глинозема Al2O3 . К важнейшим алюминиевым рудам относятся также алунит и нефелин. Россия располагает значительными запасами алюминиевых руд. Кроме бокситов, большие месторождения которых находятся на Урале и в Башкирии, богатым источником алюминия является нефелин, добываемый на Кольском полуострове. Много алюминия находится и в месторождениях Сибири.
Алюминий получают из оксида алюминия Al2O3 электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный Al2O3 получают переработкой природного боксита.
Основное исходное вещество для производства алюминия — оксид алюминия. Он не проводит электрический ток и имеет очень высокую температуру плавления (около 2050 °C), поэтому требуется слишком много энергии.
Необходимо снизить температуру плавления оксида алюминия хотя бы до 1000 oC. Такой способ параллельно нашли француз П. Эру и американец Ч. Холл. Они обнаружили, что глинозем хорошо растворяется в раплавленном криолите — минерале состава AlF3 .3NaF. Этот расплав и подвергают элктролизу при температуре всего около 950 °C на алюминиевых производствах. Запасы криолита в природе незначительны, поэтому был создан синтетический криолит, что существенно удешевило производство алюминия.
Гидролизу подвергают расплавленную смесь криолита Na3 [AlF6 ] и оксида алюминия. Смесь, содержащая около 10 весовых процентов Al2O3 , плавится при 960 °C и обладает электропроводностью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. Для дополнительного улучшения этих характеристик в состав смеси вводят добавки AlF3, CaF2 и MgF2. Благодаря этому проведение электролиза оказывается возможным при 950 °C.
Эликтролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичем. Его дно (под), собранное из блоков спресованного угля, служит катодом. Аноды (один или несколько) располагаются сверху: это — алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизеры устанавливаются сериями; каждая серия состоит из 150 и большего числа электролизеров.
При электролизе на катоде выделяется алюминий, а на аноде — кислород. Алюминий , обладающий большей плотностью , чем исходный расплав, собирается на дне эликтролизера, откуда его периодически выпускают. По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя CO и CO2.
Первый алюминиевый завод в России был построен в 1932 году в Волхове.
СПЛАВЫ АЛЮМИНИЯ
Сплавы, повышающие прочность и другие свойства алюминия, получают введением в него легирующих добавок, таких, как медь, кремний, магний, цинк, марганец.
Дуралюмин (дюраль, дюралюминий, от названия немецкого города, где было начато промышленное производство сплава). Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%) марганцем(Mn: 0,2-1%). Подвергается закалке и старению, часто плакируется алюминием. Является конструкционным материалом дла авиационного и транспортного машиностроения.
Силумин — легкие литейные сплавы алюминия (основа) с кремнием (Si: 4-13%), иногда до 23% и некоторыми другими элементами: Cu, Mn, Mg, Zn, Ti, Be). Изготавливают детали сложной конфигурации, главным образом в авто- и авиастроении.
Магналии — сплавы алюминия (основа) с магнием (Mg: 1-13%) и другими элементами, обладающие высокой коррозийной стойкостью, хорошей свариаемостью, высокой пластичностью. Изготавливают фасонные отливки (литейные магналии), листы, проволоку, заклепки и т.д. (деформируемые магналии).
Основные достоинства всех сплавов алюминия состоит в их малой плотностью (2,5-2,8 г/см3), высокая прочность (в расчете на единицу веса), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработка.
Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды, спорттоваров, мебели, рекламе и других отраслях промышленности.
По широте применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий — одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка, железа.
Алюминий применяется и для алитирования (алюминирования) — насыщения поверхности стальных или чугунных изделий алюминием с целью защиты основного материала от окисления при сильном нагревании, т.е. повышения жароупорности (до 1100 °C) и сопротивления атмосферной коррозии.
Источник: https://dpva.ru/Guide/GuideMatherials/Metalls/Aluminium/AluminiumOwerview/
Интересные факты об алюминии
Алюминий считается одним из самых известных металлов по всему миру. Как элемент, он занимает третье место по распространенности в недрах земли, уступая кислороду и углероду.
В природе его содержание составляет целых восемь процентов – это довольно много, так как золота в земле на данный момент содержится всего лишь один процент. Человечество долго не могло выявить для себя этот полезный элемент и первый слиток алюминия был обнаружен лишь в 1985 году во Франции. С тех пор он обрел всемирную известность и до полноценного открытия его изобилия в земной коре, он считался драгоценным материалом.
Обнаружение полезных свойств алюминия
Изначально алюминий добывался в малых количествах, люди не сразу смогли выявить точные участки земной коры, где находился это элемент. Из добытых слитков изначально создавались драгоценные украшения, которые мог себе позволить не каждый. Первым алюминиевым изделием принято считать медали с барельефами Наполеона. Помимо украшений из него изготавливались так же предметы искусства.
Со временем данный металл стал обнаруживаться чаще и его стали активно применять в массовой промышленности. Этот материал был удобен в применении, но стало отмечаться, что использовать его в натуральном, природном виде сложно. Он подходил не к каждой области изготовления, так как оказался не прочен. Эта проблема исчезла, когда знаменитый химик Альфред Вильм, попробовал сплавить его с некоторым добавлением других элементов – меди и магния.
Это послужило успехом, сплав получился идеальным по прочности. Уже в 1911 году благодаря этому была выпущена огромная часть усовершенствованного материала в городе Дюрен. В честь чего ему дали название — дюралюминий. Спустя восемь лет, из города состоялась первая транспортировка дюралюминия. В итоге, он навсегда завоевал весь мир.
Алюминий в производстве
В современности сложно определить сферу производства, которая обходится, без этого метала. Алюминий и на сегодня активно изучается. Большинство ученых полагают, что этот металл еще больше себя проявит в будущем с приходом новых технологий. Его основные достоинства – это высокая электропроводность, легкость в массе, устойчивость к поражению коррозии. Он технологичен и легок в использовании. Благодаря этим качествам, он позволит успешно двигать прогресс вперед.
Алюминиевые сплавы применяются в производстве крупного транспорта, машиностроении, в бытовой технике и в электротехническом производстве. Обширное использование этот металл обретает в новейших сферах технологического развития, к примеру, можно отнести ядерную энергетику.
Без алюминия никак не обойтись и в основном гражданском строительстве. Он применяется в изготовлении каркасов зданий, лестниц, окон и прочих необходимых приспособлений.
Исходя из всего этого, можно смело сделать вывод, что данный элемент имеет большую ценность, гораздо больше других, даже драгоценных металлов.
Интересные факты
- Примерно около ста лет назад, кусок алюминия весом в килограмм, стоил тысячу рублей по современным меркам, в данный момент кусок алюминия обесценился.
- В 1899 году, ученые из Англии в дар Д.И Менделееву изготовили весы, созданные из небольших частиц золота и большого количества алюминия, по тем меркам это был ценный подарок.
- В настоящее время, производство данного металла стоит на втором месте после изготовления железа.
- Алюминий входит в состав организма каждого человека, превышая массу в 140 грамм.
- Химические соединения этого металла имеются не только в недрах нашей планеты, они встречаются так же на Марсе и на Луне.
- Наполеоном был создан приказ об изготовлении алюминиевых столовых приборов. Они предоставлялись только на важных торжественных застольях, самому императору и его почетным гостям. Другие гости имели право пользоваться только приборами из золота и серебра.
- В 1860 году, алюминий пользовался спросом как модное ювелирное изделие. Каждая важная особа должна была иметь при себе такое украшение.
Источник: https://interesnie-fakti.net/interesnye-fakty-ob-alyuminii/
Значение алюминия
Алюминий значение в природе и жизни людей имеет огромное. Какая биологическая роль алюминия, Вы узнаете из этой статьи.
Алюминий – это легкий, мягкий, серебристо-белый металл, характеризующийся высокой электро- и теплопроводностью. Температура его плавления составляет 660°C. Элемент впервые получил Ганс Эрстед в 1825 году, а вот современный метод получения алюминия разработали по отдельности француз Поль Эру и Чарльз Холл.
Пластичность, легкость, стойкость к коррозии позволили алюминию снискать популярности в ювелирном деле. Ранее, из-за того, что его было сложно получить, цена на элемент было достаточно велика. В XIX веке по стоимости он не уступал золоту, поэтому подобные украшения могли себе позволить лишь богатые люди. С открытием электрохимического способа получения алюминия его стали широко использовать в промышленности.
В мировой экономике этой легкий металл имеет огромное значение. Он используется в аэрокосмической индустрии, для производства вагонов скоростных поездов, автомобилей, морских судов. Разные виды походных продуктов алюминия применяются в строительстве. Также элемент выступает основным продуктом для изготовления высоковольтных линий электропередачи. Кроме того, почти половина посуды, которую мы используем для приготовления пищи, сделана из этого металла.
Значение алюминия в жизни человека
Значение алюминия в организме тоже нельзя недооценивать: он берет участие в процессах регенерации соединительной и эпителиальной тканей, в образовании фосфатных комплексов и пептидов, поддерживает крепость костей. Металл влияет на функциональность околощитовидных желез. Элемент способен как активизировать, так и затормаживать пищеварительные ферменты. Он содержится в рисе, арахисе, фисташках, картофеле, горохе, опятах и лисичках.
Значение алюминия для растений
Недостаток алюминия в организме растений или в почве еще недостаточно изучен. А вот избыток металла его в почве провоцирует деформацию органов – на листьях появляются белые пятна и они скручиваются, сильно падает урожайность культур. Если выпадают «кислотные дожди», то в корнях образуется спектр хромосомных, хроматидных аберраций геномов.
Применение алюминия в медицине
Еще с давних времен в медицине использовали соли алюминия для заживления и лечения кожных болезней. Сегодня его применяют в дерматологии и гастроэнтерологии. Усовершенствованные компоненты обладают бактерицидными свойствами, лечат гастриты, изжогу и желудочные язвы.
Надеемся, что из этой статьи Вы узнали, чем полезен алюминий.
Источник: https://kratkoe.com/znachenie-alyuminiya/
№13 Алюминий
Около 1807 г. Дэви, пытавшийся осуществить электролиз глинозема, дал название предполагаемому в нем металлу алюмиум (Alumium). Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. В 1827 г. Велер выделил металлический алюминий более эффективным способом — нагреванием безводного хлористого алюминия с металлическим калием.
Нахождение в природе, получение:
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. алюминия в земной коре по данным различных исследователей составляет от 7,45% до 8,14% от массы земной коры. В природе алюминий встречается только в соединениях (минералах).
Корунд: Al2O3 — относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях.
Бокситы: Al2O3*nH2O — осадочные алюминиевые руды. Содержат вредную примесь — SiO2. Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов.
Каолинит: Al2O3*2SiO2*2H2O — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF3 с последующим электролизом с использованием графитовых электродов.
Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке. Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии.
Физические свойства:
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см3, температура плавления 660°C, температура кипения 2500°C. Высокая пластичность, прокатывается в тонкий лист и даже фольгу. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. Алюминий образует сплавы почти со всеми металлами.
Химические свойства:
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией.
Однако, при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами: кислородом, галогенами: 2Al + 3Br2 = 2AlBr3С другими неметаллами алюминий реагирует при нагревании:
2Al + 3S = Al2S3 2Al + N2 = 2AlN
Алюминий способен только растворять водород, но не вступает с ним в реакцию.Со сложными веществами: алюминий реагирует со щелочами (с образованием тетрагидроксоалюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Легко растворяется в разбавленной и концентрированной серной кислотах:
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Алюминий восстанавливает металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Важнейшие соединения:
Оксид алюминия, Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный — более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О Al2O3 + 2NаОН(конц.) + 3Н2О = 2Na[Al(OH)4]
(в расплаве щелочи образуется NaAlO2).
Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства.При сплавлении с NaOH образуется NaAlO2.
Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака — при комнатной температуре образуется Аl(ОН)3
Соли алюминия.
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк:Al3+ + H2O =AlOH2+ + H+
Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия — квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов).
Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным.
Бинарные соединения алюминия Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Применение:
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость, высокая теплопроводность. Алюминий является важным компонентом многих сплавов (медные — алюминиевые бронзы, магниевые и др.) Применяется в электротехнике для изготовления проводов, их экранирования.
Алюминий широко используется и в тепловом оборудовании и в криогенной технике.Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал.Алюминий и его соединения используются в ракетной технике в качестве ракетного горючего.
В производстве строительных материалов как газообразующий агент.
Аллаяров Дамир
ХФ ТюмГУ, 561 группа.
Источник: http://www.kontren.narod.ru/x_el/info13.htm
Алюминий — свойства и сплавы алюминия
Алюминий вошел в быт человека намного позже меди, однако несмотря на свой малый весь буквально, постепенно вытесняет медные изделия из многих сфер промышленности. Уступая меди по свойствам, алюминий берет свое низкой стоимостью.
Свойства алюминия
Алюминий знаком каждому с детства, как легковесный гибкий металл серебристо-белого цвета. Именно низкий удельный вес металла – 2.7 г/см3 стал одним из его важнейших свойств для человека. Дополнительный интерес к алюминию, обуславливают такие факторы:
- высокие показатели электрической и тепловой проводимости;
Широкие эксплуатационные пределы металла, его относительно низкая стоимость, способность к механической деформации прочно внедрили алюминий в наш повседневный быт. Это можно рассматривать как своеобразную дань справедливости, поскольку алюминий – вещество, наиболее распространенное в земной коре, следуя за кислородом и кремнием, но первый среди металлов.
Высокая химическая активность вещества, делает его доступным в природе исключительно как составляющий элемент минералов, в частности сапфир, рубин. Это же свойство алюминия обеспечивает формирование на поверхности металла устойчивой оксидной пленки, защищающей его от коррозии.
Воплощение высокой химической активности алюминия в сплавах
Большинство конструкционных материалов, которые принято считать алюминиевыми, изготовлено не из чистого металла, а его деформируемых сплавов. Второй класс сплавов на основе Al составляют литейные, используемые большей частью в машиностроении.
По характеру механической и термической обработки, алюминиевые сплавы относят к нагартованным, отожженным, закаленным и состаренным (искусственно или естественно). По основному легирующему элементу, различают следующие категории:
- Дюралюминий, Алюминиево-медный сплав, отличающийся прочностью на уровне низкоуглеродистой стали. Недостаток: материал требует защитного покрытия, в силу собственной низкой сопротивляемости коррозии. Среди дополнительных легирующих добавок используются: магний для повышения текучести; железо – жаропрочности, а также кремний;
Дюралюминий
- Алюминиево-магниевые. Отличаются высоким уровнем сопротивления коррозии, свариваемости и вибростойкости. Для повышения прочностных характеристик дополнительно легируются марганцем, кремнием или титаном. Широко используются для фасонного литья;
Отливки из алюминиево-магниевого сплава
- Силумин. Алюминиево-кремниевый сплав, характеризуется наилучшими литейными свойствами, поэтому целенаправленно используется для отлива корпусов различного оборудования, механизмов;
Шаровй кран из силумина
- Алюминиево-марганцевые. Такие сплавы отличаются пластичностью, обладают высоким сопротивлением коррозии, хорошей свариваемостью;
- Авиаль. Тройной сплав алюминия с магнием и кремнием. Отличается высочайшей пластичностью. Используется в авиационной промышленности. Последнее время с добавлением авиаля начали изготавливать корпуса мобильных телефонов.
Корпус самолета из авиационного алюминия (авиали)
Вторым вариантом сплавов с алюминием, выступают материалы, где металл используется как добавка. Ярким примером бытового применения таких алюминиевых сплавов является кухонная посуда: кастрюли, сковородки, миски и прочее; еще до недавнего времени широко распространенная среди населения.
Круговорот алюминия в природе
Разделают два вида чистоты металла: техническая (до 99.8%) и высокая (от 99.95%). Непосредственно производится только технический алюминий, который подвергают дополнительной очистке для получения металла высокой чистоты. Круговорот алюминия в природе можно описать следующим образом:
На фото боксит
- производственный электролиз;
- формирование (отливка) первичного металла;
- очистка или приготовление сплавов;
- переработка алюминиевого лома.
Технический алюминий используют в металлопрокате, изготавливая трубы, листовые формы, проволоку и при производстве кабельно-проводниковой продукции. Металл высокой чистоты направляют на производство обкладок конденсаторов, химической аппаратуры.
Лента из технического алюминия для трансформатора
Благодаря высокой электропроводности алюминий вытесняет медь, как материал для проведения домашней электрической проводки. Высокая теплопроводность металла, наряду с низким удельным весом, делают его незаменимым при изготовлении радиаторов домашнего отопления.
Именно благодаря алюминиевым конструкциям, тонны чугунных батарей принесли дополнительный доход сборщикам металлолома. Высокая пластичность алюминия — весомый аргумент в производстве фольги. Современные технологии позволяют изготавливать ее толщиной до 4 микрон.
Отслужив свой эксплуатационный ресурс, алюминиевый лом возвращается на пункты приема, замыкая цикл круговорота металла в природе.
Источник: http://xlom.ru/vidy-metalloloma/alyuminij-svojstva-i-splavy-alyuminiya/
Алюминий — самый распространенный металл в земной коре :
Металлы — это группа простых веществ, которые обладают характерными металлическими свойствами. Некоторые из них ценятся выше золота за удивительные характеристики, которые позволяют использовать их в самых разных сферах. Многие металлы содержатся в составе земной коры в небольших количествах. Но сегодня мы рассмотрим, какой самый распространенный металл в земной коре.
Что мы знаем об алюминии?
Да, именно алюминий является наиболее распространным металлом. Он был открыт в 1825 году датским ученым Эрстедом. Однако еще за 500 лет до нашей эры люди использовали так называемые алюминиевые квасцы. Их применяли в качестве протравы при окрашивании тканей и дублении кожи.
Алюминий, похожий на серебро внешне, изначально ценился очень дорого. Это связано с тем, что его достаточно трудно получить в чистом виде. Да и о том, что это самый распространенный металл в земной коре, известно не было. В 19-м веке, в период с 1855 по 1890 год, удалось получить лишь 200 т чистого металла.
Однако сегодня геологи утверждают, что 8 % коры Земли состоят из алюминя. Он уступает по количеству содержания в земной коре лишь кислороду и кремнию. В свободном виде в природе не встречается.
Алюминий получил широкое применение в странах СССР благодаря разработкам ученых. Найденный метод получения алюминия давал неограниченные возможности для развития алюминиевой промышленности. На его основе активно изготавливали столовую утварь, которую каждый из нас видел на кухнях у бабушек. Первый спутник СССР также был изготовлен из сплава алюминия. Применяют его и в электротехнической промышленности (кабели, цоколи, конденсаторы).
Основные свойства алюминия
Самый распространенный металл в земной коре обладает целым рядом свойств, которые позволяют активно использовать его в составе металлоконструкций. Он легок, мягок и быстро поддается штамповке.
Алюминий обладает высокой коррозийной устойчивостью. При контакте с воздухом он покрывается пленкой, препятствующей его окислению. Он неядовит (если не попадает в организм в большом количестве), обладает высокой электро- и теплопроводностью. Именно он обеспечивает передачу электроэнергии на Земле.
Однако металл не отличается прочностью. Поэтому при изготовлении металлоконструкций зачастую используется сплав алюминия с другими металлами — медью, магнием. Такие сплавы называются дюралюминий.
Электропроводность металла можно сравнить с медью, но он дешевле, поэтому ему нашли более широкое применение. Один из немногих недостатков алюминия — его тяжело паять из-за прочной оксидной пленки. Кстати, он легко воспламеняется и если бы не эта оксидная пленка, он горел бы на воздухе.
Алюминий — драгоценный металл
Интересно, что в 19-м веке алюминий очень ценился. За килограмм металла просили около 3 000 франков. Поэтому ювелиры активно изготавливали украшения на его основе. Ведь металл легко поддается обработке, обладает красивым серебристым оттенком и позволяет придавать изделию любую форму.
Однако уже через несколько лет он стал падать в цене и вскоре вышел из моды. Многие алюминиевые драгоценности не пережили обесценивание металла. Сегодня они — большая редкость.
Совсем недавно алюминий стал главной темой выставки, организованной в Питтсбурге (штат Пенсильвания) в музее Карнеги. Интерес к нему появляется снова. Самый распространенный цветной металл в земной коре сегодня применяется в виде металлической пены. Это новейшая разработка, на основе которой можно изготавливать даже корабельные корпуса.
Вред алюминия
Еще в 1960 году ученые выяснили, что в мозге у людей, страдающих болезнью Альцгеймера, присутствует высокий уровень алюминия.
Недавние исследования подтвердили, что металл вызывает ускоренное старение клеток мозга, становится причиной дегенеративных неврологических заболеваний. Низкая усвояемость алюминия дает ложное представление о его безопасности для организма.
Но на самом деле длительный прием его небольших доз в конечном итоге вызывает отключение нейронов головного и спинного мозга.
Золото — самый часто встречающийся драгоценный металл
Золото является самым распространенным металлом в земной коре среди благородных. Когда-то людям были известны лишь 2 драгметалла — золото и серебро. Однако позже список расширился. Сегодня благородными являются платиновая группа металлов. В эту группу, помимо платины, входят также ее элементы — родий, осмий, рутений и иридий. Кстати, иридий — самый редкий металл в этой группе. Благородным признан и технеций, однако из-за радиоактивности его не включили в список драгоценных.
Золото, как и другие благородные металлы, обладает рядом уникальных свойств. Оно блестит на открытом воздухе, ему не вредит длительное пребывание в воде, а также воздействие щелочей и кислот, высоких температур.
Золото легко поддается обработке, обладает высокой плотностью. Металл встречается в виде самородков, песка и в сочетании с другими элементами. Однако при этом золото уступает многим металлам по прочности и устойчивости.
Сегодня это далеко не самый дорогой драгметалл. Цена его составляет $45 за 1 грамм.
Источник: https://www.syl.ru/article/370047/alyuminiy---samyiy-rasprostranennyiy-metall-v-zemnoy-kore
Натуральная бирюза: отличия настоящей и прессованной, как проверить подлинность, минерал, как отличить от подделки и других камней
Бирюза – это красивый минерал, встречающийся вювелирных украшениях. Натуральная бирюза эталонного качества редко встречаетсяв природе, поэтому имеет высокую стоимость. Сегодня применяются разнообразныетехнологии облагораживания добытых минералов.
Нередко вместо природной бирюзыпокупателю предлагают подделку. Это могут быть как более дешевые камни,окрашенные специальными составами, так и прессованная бирюза. Отличитьподделку от настоящего самоцветапомогут знания о свойствах и внешних характеристиках подлинного самоцвета.
Характеристикакамня
Камень бирюза – это минерал, обладающий небесно-голубым, зелено-голубым или серо-зеленым оттенком. Цветовая основа камня также может иметь желтоватые вкрапления. С точки зрения химического состава представляет собой водный фосфат меди с примесью алюминия. В природе встречается в форме скрытокристаллических агрегатов, прожилков, корок и натечных образований. Формированию залежей способствуют геотермальные процессы, происходящие при температуре до 180 градусов.
Цвет минерала зависит от степени зрелости. Так, молодой самоцвет имеет бледно-голубой оттенок. Зрелая бирюза обладает насыщенным цветом. Если камень слишком стар, он характеризуется бурыми оттенками. С точки зрения ювелирного искусства старый минерал считается малоценным.
Твердость настоящей бирюзысоставляет 5-6 баллов по шкале Мооса. Минерал полностью непрозрачный. Имеетмаслянистый блеск. Природный самоцвет портится под воздействием высокихтемператур.
Альтернативныеназвания:
- аризонит;
- агафит;
- туркиз;
- арабский, синайский, небесный камень.
Способыотличия прессованных видов самоцветы
Камни эталонного качества, нуждающиеся лишь вогранке и шлифовке, крайне редко встречаются в природе. Стоимость украшений стаким камнем высокая. Более низкое качество в сравнении с натуральной бирюзойимеет укрепленная. Это минерал, подвергающийся механическим манипуляциям сиспользованием укрепляющих составов. К таковым относят:
- парафин;
- жир;
- выпаренный кварц и прочее.
Аналогичную ценность имеет облагороженная бирюза. Это камень, внешний вид которого был улучшен красителями. Минерал в результате такой обработки выглядит неестественно – они слишком яркий и блестящий.
Наиболее популярным заменителем природной бирюзысчитается прессованная. Ее получают методом прессования крошек минералавысокого качества, остающихся после огранки и шлифовки. Многие называютпрессованную бирюзу искусственной, но это не такна самом деле. Такой камень имеет натуральное происхождение. Однако важно знатьспособы, помогающие отличить минерал, полученный из бирюзовойкрошки:
- цена: стоимость прессованного камнязначительно ниже цены минерала, имеющего полностью натуральное происхождение;
- оттенок и блеск: прессованный самоцветяркий и блестящий;
- рисунок: прессованный камень имеетхарактерный узор в виде паутинки.
Важно! Если рассмотреть некачественную прессованную бирюзу через стекло микроскопа, можно обнаружить посторонние включения в виде песка и соринок. Чтобы быть полностью уверенным в происхождении бирюзы, камень лучше отдать на экспертизу опытному геммологу.
Видынеоригинального самоцвета
Обывателю сложнонайти отличия междунастоящим самоцветом и фальшивкой, так как последние имеют те же внешниехарактеристики.
Обязательно посмотрите: Как и где добывают алмазы
Стеклянныеобразцы и дешевые подделки
Стекло и пластик – это дешевые материалы, которые после соответствующей обработке выглядят как камни бирюзы. Стеклянная или пластиковая подделка имеет неестественно яркий цвет и правильный орнамент, нехарактерный для натуральных экземпляров. Камень можно легко поцарапать острием иглы, потому что он имеет низкий показатель твердости. Также фальшивки быстро нагреваются от тепла человеческих рук.
Похожиеминералы
В природе встречаются самоцветы, которые визуальнонапоминают бирюзу. Они имеют более низкую себестоимость.
Варисцит
Это редкий поделочный камень, который еще называюткалифорнийской бирюзой. Имеет похожую цветовую гамму. Варисцит обладаетвыраженной прозрачностью и большим количеством зеленых прожилок. Показательтвердости этого камня более низкий.
Лазурит
Поделочный камень имеет насыщенно синюю основу, дополняемую золотистыми вкраплениями. Для того, чтобы сделать минерал точной копией бирюзы, мастера применяют различные красящие составы. Лазурит обладает тонкозернистой структурой. Отличить один камень от другого поможет детальная экспертиза, посвященная тщательному изучению химического состава минерала. Также в качестве заменителя природного самоцвета используют туркенит.
Говлит,халцедон и кварц
Окрашенный бирюзовой краской говлит напоминает драгоценный минерал. Однако дешевый аналог более пластичный на ощупь. Окрашенные говлит, халцедон и кварц выглядят неестественно яркими и блестящими, если сравнивать их природной бирюзой. Кварцевый камни отличаются тем, что они просвечиваются по краям. Халцедоны более тяжелые, чем оригинальный минерал.
Нравится ли вам камень бирюза?
Ондолит
Ондолит – этоокаменелыеостанки (зубы, бивни, когти) животных. Камни органического происхождения легкоподдаются окрашиванию. В отличие от настоящий бирюзы, быстро растворяются всоляной кислоте.
Способы подделки
Мастера научились изготавливать высококачественные подделки дорогостоящего камня бирюза. Имитации условно делятся на 2 категории: с натуральной бирюзой и с синтетическими компонентами в составе.
Сиспользованием натуральной бирюзы
Есть методы создания имитаций камня, основанные наиспользовании природного сырья.
| Материал | Как получают |
| Прессованный камень | Наиболее распространенный способ имитации. В состав смеси для прессования входит крошка, полученная в процессе шлифовки и полировки высококачественного минерала. Нередко в формулу массы входят и примеси других минералов, стоимость которых ниже цены подлинной бирюзы. Полученный из минералов порошок склеивается специальным клеем, после чего прессуется в брикеты. Затем из брикетов высекаются бусины и вставки для ювелирных украшений. Наиболее качественной и ценной прессованной бирюзой считается сетчатая или паутинная. Она характеризуется наличием красивого орнамента. Восстановленный из порошка камень можно встретить в разнообразных украшениях: серебряных и золотых кулонах, серьгах, браслетах, брошках, кольцах. |
| Венская | Прессованная смесь, которая состоит из малахита, а также дополнительных компонентов в виде фосфорной кислоты, гидроокиси алюминия. Все вещества подвергаются тщательному измельчению, что позволяет спрессовать их. Венская бирюза разрушается под воздействием высоких температур – камень плавится, а затем растрескивается. Материал используется в производстве бижутерии, сувениров, предметов декора. |
| Стабилизированная | Мастер наполняет специальными составами поры самоцвета, образующиеся в результате природных процессов. Вещества, используемые для заполнения дефектов, состоят из воска или смол. |
| Окрашенные старые минералы | Бирюза имеет нестабильный химический состав, поэтому меняет внешний вид. В процессе старения окрас приобретает желто-зеленые вкрапления, площадь которых постепенно увеличивается. Стоимость таких самоцветов снижается, но окрашивание старых образцов специальными составами позволяет возобновить привлекательность цвета. |
Синтетические
Синтетические аналоги бирюзы не имеют в своемсоставе природные минералы. Фальшивки состоят из:
- стекла;
- керамики;
- пластмассы;
- пластика.
Обязательно посмотрите: Где и как добывают изумрудыИскусственные самоцветы используются в производстве недорогой бижутерии и сувениров. Но если в информации об изделии упоминается слово «бирюза», то это обман со стороны продавца. Также мошенничеством считается продажа искусственных самоцветов по цене подлинных экземпляров.
Какотличить подделку
Если вы задумываетесь о покупке изделий из лазурногокамня, будьте внимательны, чтобы не попасться на уловки мошенников и непотратить деньги на фальшивку. Есть приемы, которые помогут избежать ошибок припокупке украшений.
Как отличить настоящий минерал от дешевых копий:
- Грубуюподделку легко отличить от настоящего экземпляра, так как ее поверхностьпокрыта некачественным красителем. Чтобы выполнить тест, возьмите тканевуюсалфетку и нанесите на нее спирт. Салфеткой тщательно протрите камушек. Если наней окажутся следы краски, это означает, что перед вами некачественновыполненная подделка.
- Раскалитеобычную швейную иглу. Ее острием прикоснитесь к поверхности камня. Еслипоявится нехарактерный химический запах, это свидетельствует о том, что копияизготовлена из полимеров. Если в составе изделия есть уплотняющие смеси, то наместе прокола выступит клейкая капля.
- Рассмотритекамень под лупой. Трещины и пузырьки – это признаки синтетических подделок.
- Бирюзесвойственно наэлектризовываться при трении о шерстяную ткань. Послемеханического воздействия к образцу пристанут пылинки и шерстинки.
- Откажитесьот покупки украшения с крупной вставкой, так как в природе массивные экземплярыкамня не встречаются. Также не изготавливают большие вставки из спрессованноймассы.
- Натуральныйсамоцвет обладает едва уловимый восковым блеском, в то время как фальшивкапривлекает внимание выраженным глянцевым отливом.
- Попробуйтепоцарапать образец иглой или острым ножом. На оригинальном экземпляре останетсятонкая царапина, так как самоцвет обладает средним показателем твердости. Еслиповредить камень не удается, то это свидетельствует о том, что он являетсякопией, изготовленной из кварца или халцедона.
Важно! В домашних условиях отличить прессованную бирюзу от той, которая была добыта в природе, не удастся. Чтобы не потратить деньги на копию, обращайте внимание на репутацию ювелирного магазина, в котором приобретаете украшения.
Попросите продавца предъявить документ, доказывающий подлинность самоцвета. Остерегайтесь покупки изделий с камнями в местах несанкционированной торговли. Дать точную оценку происхождения минерала может только эксперт-геммолог.
Основныевыводы
- Бирюза– это натуральный камень, представляющий водный фосфат меди с примесямиалюминия в составе. Эстетически привлекательные экземпляры имеют высокуюстоимость.
- Из-затого, что высококачественные самоцветы встречаются в природе редко, естьтехнологии облагораживания бирюзы, а также ее восстановления из крошки камня.
- Стабилизация,прессование, окрашивания – это популярные методы облагораживания. Такую бирюзунельзя назвать синтетической, поскольку она имеет натуральное происхождение.
- Имитацииминерала изготавливаются из более дешевых камней, к которым относят лазурит,халцедон, кварц. На заменители наносят специальную краску, имитирующуюприродную расцветку бирюзы.
- Подделкипроизводят из таких материалов как стекло, пластмасса, эмаль и керамика.Изготовленные из искусственного сырья вставки используются в производствебижутерии. Также они могут продаваться по цене подлинных минералов, чтосчитается мошенничеством.
- Некоторыеметоды, применяемые в домашних условиях, помогут выявить низкокачественнуюподделку.
Однако достоверный результат даст только геммологическая экспертиза,особенно, если рассматривается прессованная бирюза.
Источник: https://kamnistar.com/interesnoe/naturalnaya-biryuza/
Алюминий – где встречается в природе?
Сегодня можно часто слышать утверждение, что алюминиевая посуда вредна для здоровья. Так ли это на самом деле?
Существует легенда, что знаменитый Менделеев во время изучения элемента алюминия решил сделать из него столовый прибор – ложку. Изобретение было подарено царской особе. В нынешнее время эта ложка находится на хранении в одном из музеев Санкт-Петербурга. Позже столовыми приборами из алюминия стали пользоваться особы из высшего общества, а для придворных были предназначены серебряные.
Получение алюминия в условиях лаборатории — удовольствие недешёвое, но в природе его можно встретить довольно часто в составе руд. Насколько безопасна посуда алюминиевая? Вред, который она может нанести организму, до конца не доказан.
Примеси алюминия есть в составе боксита (разноцветной глины). Когда в ней присутствуют элементы железа, глина приобретает красный оттенок. Встречается она и белого цвета, называется каолин. Применяется такая глина для производства сосудов из фаянса и фарфора. Древние люди на протяжении тысячи лет использовали в быту посуду из этого материала. Известно, что в состав глины также входит алюминий, но никаких проблем со здоровьем в результате этого не отмечалось.
В чем опасность на самом деле?
Чем вредна алюминиевая посуда, которой мы пользуемся сегодня? Не так давно можно было встретить посуду из этого металла в каждом доме. Как сырье алюминий недорог, вместе с этим он ещё гибкий и легкий. Благодаря этим свойствам он является отличным проводником тепловой энергии, что даёт возможность очень быстро нагревать продукты.
Крупы, например, не «пристают» ко дну, молоко не подгорает, но оставлять на хранение приготовленную еду в такой посуде нельзя. Алюминиевая кастрюля также не предназначена для хранения продуктов, содержащих различные кислоты. В противном случае непременно произойдет окислительная реакция.
Если при приготовлении еды продукты пригорели ко дну, ни в коем случае счищать их для употребления в пищу нельзя.
Известно, что примеси алюминия могут попадать человеку в организм в критически малом количестве.
Нельзя игнорировать тот факт, что примеси алюминия постепенно накапливаются в организме человеке. В 70-х годах XX столетия ученые из Канады провели исследования и пришли к заключению в том, что у людей, страдающих заболеванием Альцгеймера, повышено содержание 13-го элемента в мозговых клетках. Неужели в этом виновата посуда из алюминия? Установить причинно-следственную связь между болезнью и использованием данной утвари так и не удалось.
Рекомендации по использованию алюминиевой посуды
Советы просты и легки для запоминания.
Вредна ли алюминиевая посуда для организма?
Исходя из информации, предоставленной Всемирной организацией здравоохранения в 1998 году, природный алюминий, встречающийся в еде и воде, не несет угрозы для здоровья людей и не способен вызвать рост раковых клеток и развитие онкологии.
Сегодня наибольшую угрозу несет производственный алюминий, так как при его изготовлении нещадно страдает окружающая среда. Но почему же сегодня часто говорят о том, что небезопасна и посуда алюминиевая? Вред, который она может нанести, связан с ее неправильной эксплуатацией.
Предметы, изготовленные из алюминия, меняют цвет, темнеют, если подвергаются воздействию химических реагентов. Сам материал вполне прочен, но легок. Это означает, что при работе с ним следует быть внимательным и аккуратным.
Различная бытовая утварь из алюминия часто пачкается и требует чистки. Поэтому необходимо знать и уметь правильно избавиться от накипи и следов использования. При нормальном уходе достаточно долго может служить посуда алюминиевая.
Вред ее в таком случае будет сведен к минимуму.
Руководство по чистке и использованию предметов из алюминия
Большинство домохозяек предпочитают именно алюминиевую посуду. Почему? Все предельно просто: алюминий — отличный проводник тепла, а значит, продукты в такой посуде разогреваются моментально и не пригорают. Сосуды из алюминия практически не изнашиваются, легко эксплуатируются.
Наверное, все не раз замечали, насколько ярко сияет еще не использованная алюминиевая посуда в магазине? Это преимущество часто привлекает хозяек, и они тут же стремятся приобрести эту красоту.
Жаль, что спустя время сияние сходит на нет, образуется накипь. Этим не в положительном ключе славится посуда алюминиевая. Вред от нее может быть только при неправильном уходе.
Для возвращения былого блеска любимой кастрюле кухарки прибегают к использованию бытовой химии, но увы, результаты не оправдывают надежд.
Однако есть масса вполне легких и доступных каждому способов, при помощи которых алюминиевая посуда будет очищена и приобретет былую новизну. Прежде чем начать чистку алюминиевых сосудов, следует прочитать некоторые рекомендации:
Алюминиевая посуда. Уход с использованием народных средств
Предлагаем ознакомиться с самыми популярными способами, благодаря которым посуда будет очищена от жира, грязи, налета и накипи.
- Часто на дне кастрюли проявляются темные следы. Избавиться от них можно, залив кефиром, рассолом либо скисшим молоком.
Любой из этих трёх продуктов нужно налить на дно и спустя 24 часа сполоснуть.
- Следы нагара сойдут после того, как вы прибегнете к помощи кислых яблок. Для этого мелким куском фрукта необходимо натереть внутреннюю поверхность.
Кислота, входящая в состав мякоти, очистит посуду. С аналогичной целью разрешается применить лимонный сок.
- Единственным, пожалуй, минусом алюминия считается его уязвимость к окислению. Чтобы избавиться от следов окислительного процесса, рекомендуют использовать такой способ: разведите соль с водой в соотношении один к одному. Полученный состав нанесите на участки, где произошла реакция, и протрите тряпкой. При приготовлении смеси нужно помнить, что по консистенции домашнее средство должно быть примерно как густая сметана. Таким образом легко чистятся темные следы внутри алюминиевого термоса.
Избавиться от нагара поможет смесь клея и пищевой соды
Не стоит расстраиваться, что кастрюля со временем утратила свой вид, и невозможно избавиться от старого нагара. Для этого необходимы:
- большая миска;
- пищевая сода – 100 граммов;
- горячая вода – 10 л;
- канцелярский клей – 100 граммов.
Чтобы от нагара не осталось и следа, нужно налить в миску воду, в ней растворить все составляющие. Посудину опустить в полученный раствор и оставить на три часа. После ополоснуть и насухо вытереть тряпкой.
Уксус 9% против налета и пятен
Темные следы с поверхности алюминия удаляются при помощи столового или яблочного уксуса. Он наносится на сухую тряпочку, которой и протирается нужная область на поверхности.
https://www.youtube.com/watch?v=aoicGR-JWQA
Применяя любой уксус либо пищевую кислоту, можно избавиться от следов накипи следующим образом:
200 г уксуса разводятся в литре воды, и данный раствор заливается в ту емкость, которую вы желаете очистить. Далее следует вскипятить жидкость на огне. После остывания можно приступить к чистке.
Состав из мыла, чтобы очистить анодированный алюминий
Много кто хранит в быту вещи из анодированного алюминия, к примеру, молдинги. Эти изделия обладают желтоватым оттенком. Здесь необходим квалифицированный уход.
Проводить мытье изделий из такого вида алюминия возможно с использованием специального мыльного состава, который готовится разведением порошка в воде. Таким образом удалится грязь, но сияния металлу это не придаст. Чтобы добиться блеска, следует взять 15 граммов буры и смешать с 5 граммами нашатырного спирта. Образовавшийся состав наносится на поверхность. При этом стоит работать в перчатках. Обработав предмет, обязательно смыть состав водой.
Сода поможет избавиться от накипи
Чтобы очистить посуду от накипи, домохозяйки прибегают к старому способу, делая это при помощи пищевой соды. Для получения кашицы нужное количество воды разводят с содой до необходимой консистенции. Полученным составом промазывают участки с накипью, а после смывают водой с добавлением нашатыря. Это весьма простой и действенный способ достичь чистоты и сияния вашей посуды.
Правильный уход за такой посудой – залог ее долговечности и безопасности. А вред алюминиевой посуды – миф, пока ничем не подтвержденный.
Источник: https://HochyVseZnat.ru/aluminii-gde-vstrechaetsia-v-prirode.html